
ヘミアセタール・ヘミケタール形成は糖が有する重要な性質の一つです。グルコースのような糖はホルミル基やケト基を有するため、分子内の水酸基から攻撃を受けて結合を形成し環状構造をとります。この時の分子の方向性によってα体ができたり、β体ができたりします。一度できた環状構造もいたずら者が切ってしまうように一定確率で結合が切れて鎖状構造に戻ります。この結果、α体、鎖状構造、β体が一定割合でバランスします。今回はこの現象の根本となるヘミアセタール、ヘミケタール形成について解説します。
Contents
比旋光度
ヘミアセタール・ヘミケタールについて理解するためには比旋光度を理解する必要があります。そこで比旋光度について解説しようと思います。
光の振動方向は試料溶液を通ると回転する
光は通常波として解釈されます。波には振動方向があり、通常の光には様々な振動方向を持つ光が混ざっています(イメージとしては波の山と谷が向く方向が上下であったり、左右であったりと、様々な方向を向くとイメージしてもらえるとわかりやすいと思います)。偏光子は特定の振動方向を向いている光だけを通すことができる素子のことを言います。図1では光源から出た光が偏光子を通ることで特定の振動方向をもつ光だけが通り抜けて、試料管に到達しています。試料管内には測定したい試料を溶かした溶液が封入してあります。この中を通って出てきた光を検出するのですが、この時にもう一つ偏光子を用意しておきます。普通に考えれば、試料管に入る前の偏光子と同じ角度の時に光が透過して出てくると予想できるはずですが、実際には図1に示すように偏光子を少し回転させてやらないと光が透過せず検出できません。この現象は試料管を通り抜けることで光の振動方向が少し回転していることを表します。このように光の振動方向を回転させる性質のことを旋光性といい、偏光子を回転させた角度を旋光角といいます(図1では α であらわしています)。実はこの現象、有機化学ではとても重要な現象です。というのも立体異性体を見分けるのに有力な手法だからです。通常、立体異性体は化学的性質が同一であることも珍しくなく、見分けるのがとても難しいものです。ところが旋光性を利用すると、立体構造が異なると旋光角も変化しますので見分けることができます。
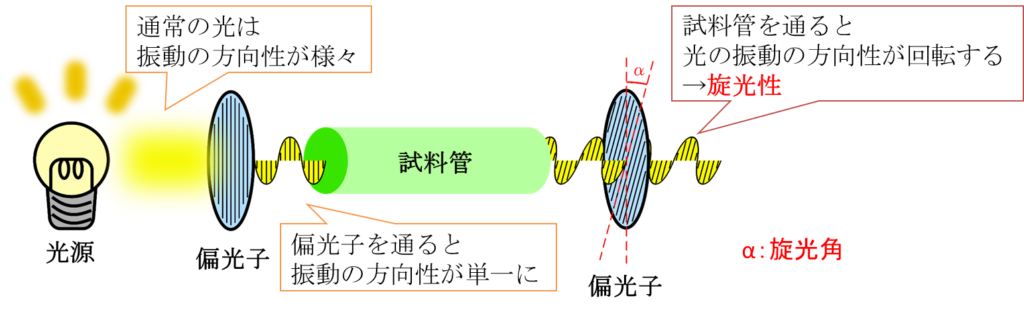
立体構造の違いを比旋光度で見分けることができる
立体構造の違いを比旋光度で見分けることができる

旋光角は試料の濃度や試料管の長さに比例しますので、旋光角で比較しようとすると、同じ物質でも実験条件によって数値が違ってしまいます。そこで旋光度を比較する場合には諸条件をそろえるために比旋光度を利用します。比旋光度は右の式で算出します。
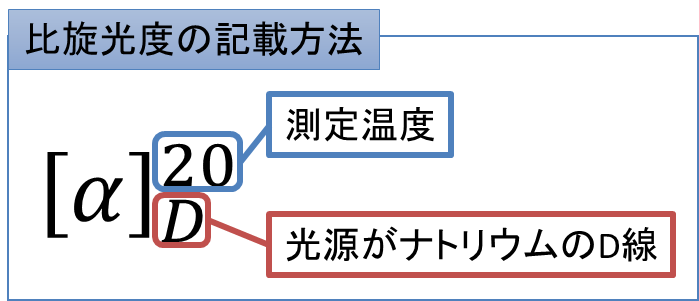
なお、比旋光度の記載方法は図2に示す通りです。
さてこの時 [α] の右上に書いた数値は測定したときの温度を表します。下は使用した光源を表しています。Dは “ナトリウムのD線” という意味です。
比旋光度は各化合物の立体異性体ごとに特有の値を示しますので、比旋光度を見ることで、立体構造の違いや変化を見分けることができるというわけです。
変旋光と環状構造・鎖状構造
糖は溶解して放置すると比旋光度が変化する
D-グルコースは冷エタノールから析出させてから水に溶解させて比旋光度を測定すると 112.2° になります。一方で、熱ピリジンから析出させてから水に溶解させて比旋光度を測定すると、比旋光度は 18.9° になります。ところが、いずれの場合も溶液の状態で放置しておくと、比旋光度が徐々に変化して最終的に 57.2° になって落ち着きます。この現象を変旋光といっています(図3)。この現象について少し考察していきましょう。変旋光は比旋光度が変化することから立体構造が変化していることを意味しています。それが 57.2° で落ち着くということは、元々、112.2° だったり、18.9° を示すような構造を持つ物質だったものが、57.2° の比旋光度を持つような状態になって落ち着くことを意味しています。
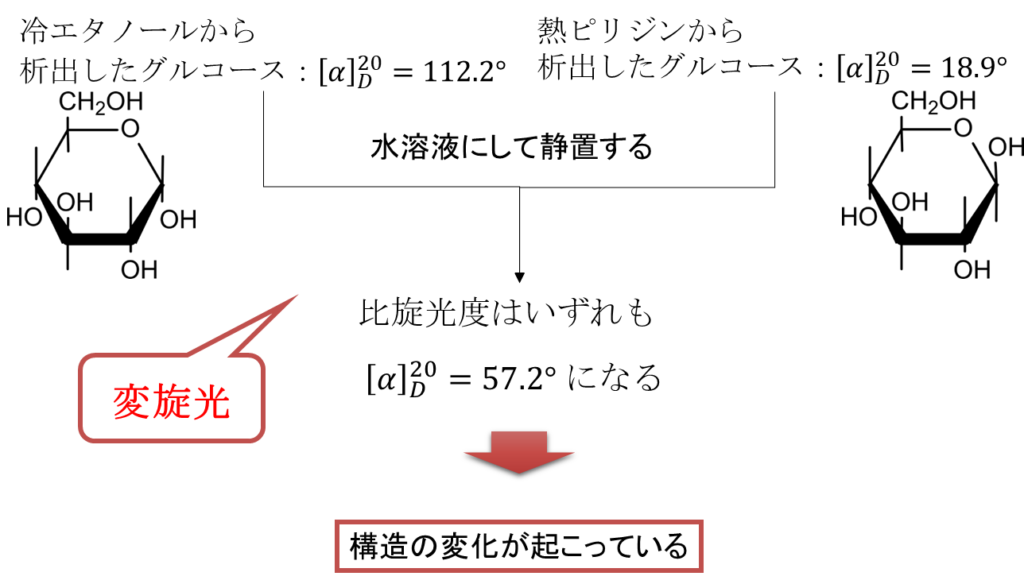
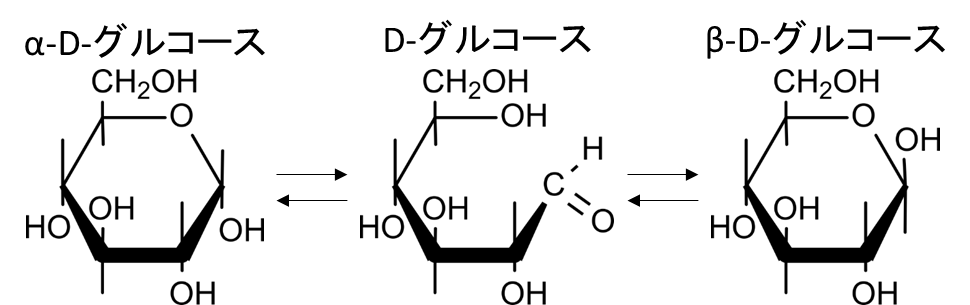
実はこの現象、図4のような平衡を形成することで起こります。冷エタノールから析出したものは図4の α-D-グルコース (左端) になります。一方で熱ピリジンから析出した場合 β-D-グルコース (右端) になります。この二つのD-グルコースは右端の水酸基が下についているか、上についているかが異なります。この違いが比旋光度の違いを生んでいるわけです。この二つの構造はいったん鎖状構造を挟んで互いを行ったり来たりします。この反応は最終的に互いの反応速度がバランスして見た目上 α-D-グルコース、鎖状の D-グルコース、β-D-グルコースの濃度が変化しなくなります。この状態を平衡状態といいます。この時の比旋光度は 57.2° となるわけです。
化学結合論について
ここからの解説では化学結合論が重要となります。そこで、今回のトピックスからは少し外れますが、k額結合論について確認しておきます。
電荷の偏りが化学反応の起点となる
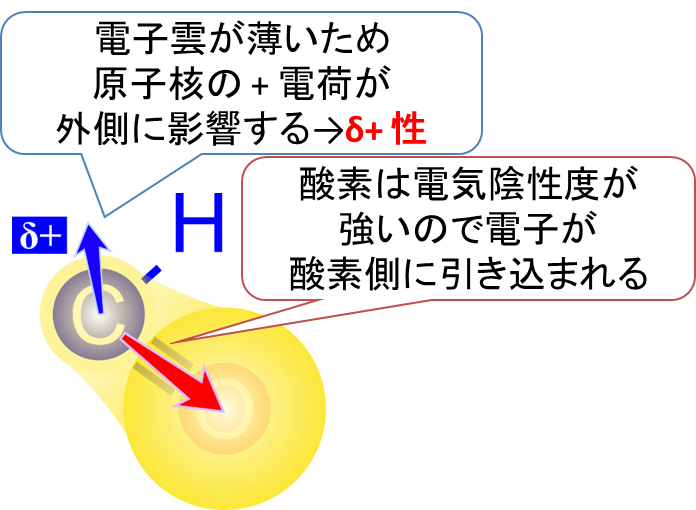
本題に入る前に、δ+ 性について説明しようと思います。この概念は様々な化学反応の基本となる重要な概念ですので、よく理解しておきましょう。炭素に比べ酸素は電気陰性度がとても強い原子です。つまり酸素は電子を引っ張る力とても強いのです(酸素は全元素の中で二番目に電気陰性度が強い元素です)。このため、炭素と酸素間の電子の局在はアンバランスになっています(図5)。
さて、原子の周りにある場合、電子は雲のような状態で存在しています。これを電子雲といいます。電気陰性度の差によって、電子雲は酸素側が濃く、炭素側が少し薄くなっています。ちょうど図5のようなイメージでとらえるとわかりやすいかと思います。
電子雲が均等に局在していると原子核の+電荷が電子の-電荷で打ち消されて電気的に中性になりますが、炭素側では電子雲が薄くなっているため、原子核が持つ+電荷を打ち消しきれなくなります。その結果、炭素原子は少し+に荷電している状態になります。この電荷は電子1個分には満たないので δ+と表現され、このような状態を δ+性といいます。この電荷の偏りは様々な化学反応の起点になりやすいので注目するべきポイントになります。
二重結合には σ 結合と π 結合が含まれる
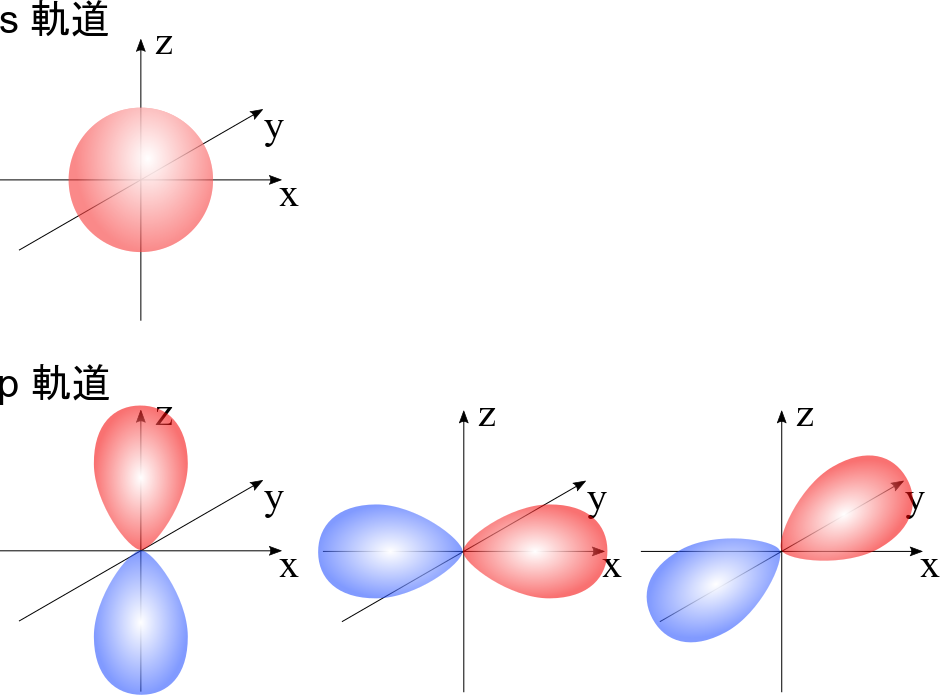
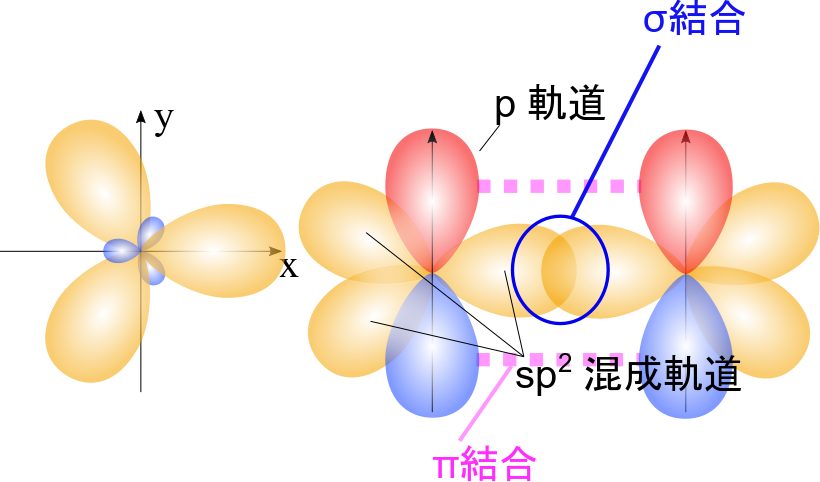
ここで混成軌道について簡単に触れておきます。詳しくは化学結合論を勉強してください。通常、炭素の最外電子殻の電子配置は 2s22p2 (s 軌道に2個の電子、p 軌道の二つに一つずつの電子の配置)です。ところが、この電子配置では化学結合の形状を説明できません。例えば、二重結合をもつ結合の場合は平面三角形になりますが、s軌道は球形ですし、p 軌道は3つあってそれぞれ x 軸方向、y 軸方向、z 軸方向に局在した形をしています。ここで、p 軌道は赤色と青色で合わせて一つであることに気を付けてください。さて、これらの形をどう組み合わせても、平面三角形にはなりません。そこで考案された概念が混成軌道です。
炭素で二重結合を形成する場合 s 軌道一つと p 軌道二つが混ざって新しい軌道を形成します。すると図7のようになります。sp2 混成軌道 (左) は正三角形の各頂点に向かって伸びた形状になっています。sp2 混成軌道とp 軌道を合わせて描くと右側のようになります。二重結合は sp2 混成軌道の共有により形成される σ 結合と p 軌道の重なりで形成される π 結合の二種類の結合で形成されています。π 結合を形成する電子は p 軌道をとっているので比較的移動しやすい電子です(図7)。つまり、軌道が重なり合うことでがっちり固定されているのが σ 結合、そこまで固定されていないので状況によっては混成軌道を形成して新しい結合を作ったり、遷移してしまいやすいのが π 結合と考えるとわかりやすいと思います。これが二重結合をもつ化合物が高い反応性を持ちやすい理由です。
分子内ヘミアセタール形成について
図8を見てください。まず重要なことは 5位の水酸基は立体構造上ホルミル基と近接位置にきます。したがって5位の水酸基とホルミル基が反応を起こすことになります。
さて、図8に示すように、ホルミル基の炭素は δ+性を有するため、5位の水酸基がホルミル基の炭素を攻撃します(”求核的に攻撃する” といいます。水酸基の非共有電子対(電荷-)が炭素原子(電荷+)に引き付けられて攻撃するイメージです)。この結果、炭素と酸素間に結合が形成されますが、そうなると二重結合のままでは炭素の結合の手が5本になってしまいます。そこで π 電子が酸素側に遷移(移動)します。そこに水素イオン(プロトン)が結合し水酸基に変換されます。こうして5位の水酸基の酸素と1位の炭素がつながって環状構造のグルコースが形成されました。この構造はホルミル基とアルコールに起因するものでヘミアセタールと呼ばれます。
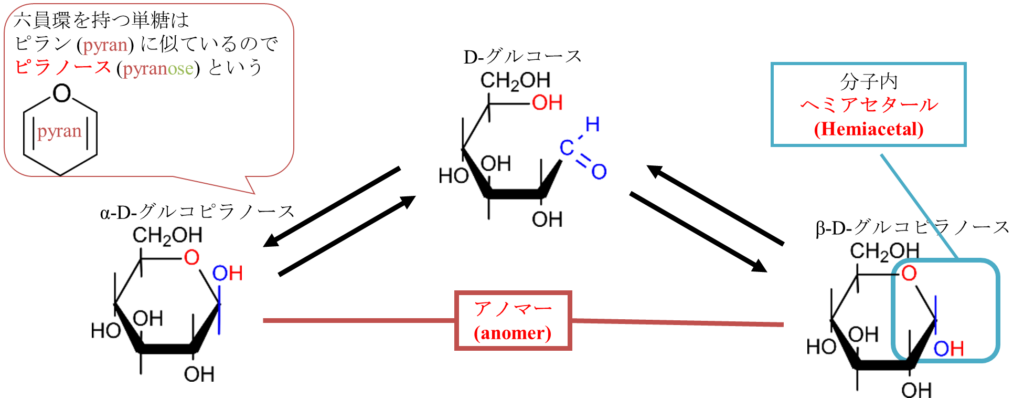
ここで図8に注目してください。ヘミアセタール形成が起こるときにホルミル基の酸素が下側に来ると環状構造を形成したときに水酸基が下向きについた構造になります(α体)。一方で酸素が上側に来ると水酸基が上向きについた構造になります(β体)。このようにして形成された立体異性体の関係をアノマーといいます(図9)。D-グルコースのように環状構造を形成した結果、六員環(六角形の構造)になった場合、生成された環状構造がピランに似ているためピラノースと呼びます(ピラノースという呼称は分子の形に基づく名称です。ヘミアセタール形成されたものかヘミケタール形成によるものかは関係がないので注意してください)。
分子内へミケタール形成について
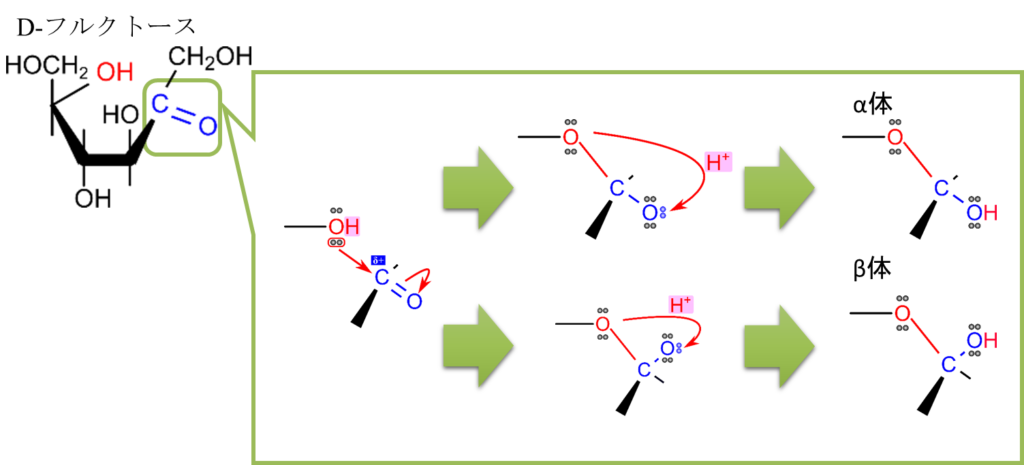
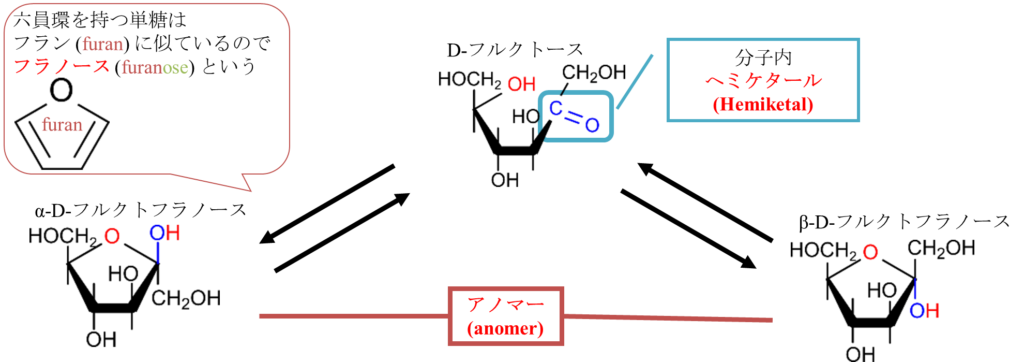
図10を見てください。図10では D-フルクトースの環状構造形成について示しています。この反応も分子内ヘミアセタール形成と同様のメカニズムで起こります。つまり、5位の水酸基がケト基の炭素を求核的に攻撃して結合を形成します。さらに、π 電子が遷移したのち、プロトンが付加されて、水酸基に変換されて環状構造が形成されます。この構造はケト基とアルコールに起因するものでへミケタールと呼ばれます。ヘミアセタールと似ていますがアルデヒド基が関与するかケト基が関与するかで呼び方が変わりますので気を付けてください。

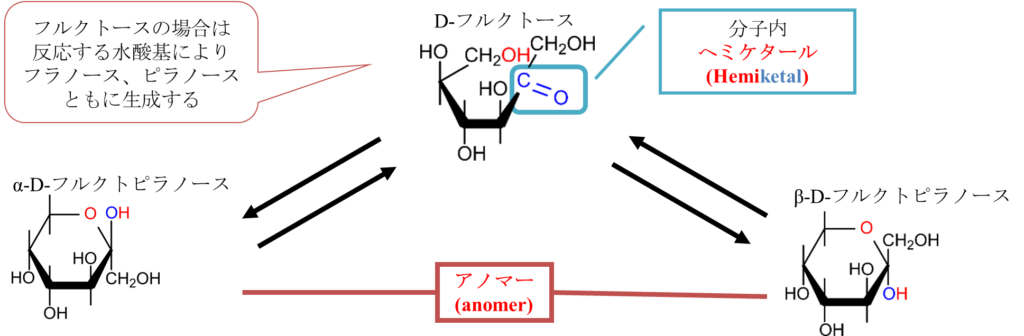
さて、D-フルクトースの場合は反応する水酸基が2通りあります図11、12にその2通りを示します。図11に示すように5位の水酸基とケト基がへミケタール形成をすると五員環(五角形の構造)になります。この構造はフランに似ているためフラノースといいます。なお、D-グルコースの時と同様 α 体と β 体も形成され、この場合にもアノマーが存在します。
一方で図12に示したように6位の水酸基が反応するとピラノースが形成されます。この場合もα 体と β 体が形成され、アノマーが存在します。D-フルクトースの場合はフラノースとピラノースの両方が形成されます。
練習問題
今回は、糖の基本的な性質であるヘミアセタール形成とヘミケタール形成について解説しました。これらの反応は、糖鎖の還元性や反応性を支える重要な化学的基盤であり、グルコースとフルクトースの異性化など、さまざまな代謝反応の起点にもなります。
また、δ⁺性を示す炭素への求核的攻撃や π電子の遷移など、化学結合の基本原理が関与している点も見逃せません。
本記事では、単に反応機構を紹介するだけでなく、これらの現象を支える有機化学的な知見まで踏み込んで説明しました。糖化学をより深く理解するために、ぜひ繰り返し読み返し、反応の意味をより深いレベルで捉えてみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 5-34
- 2.Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 290-313
- John McMurry著、伊東椒、児玉三明訳 (2000). マクマリー有機化学 第4版. 東京化学同人. pp. 439-470
- K. P. C. Vollhardt, N. E. Schore著、古賀憲司、野依良治、村橋俊一、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人訳 (2020). ボルハルト・ショアー現代有機化学 第8版. 化学同人. pp. 1425-1486
関連記事
糖鎖の基本について
糖鎖の化学反応について
オリゴ糖・多糖について
解糖系について
- 解糖系(glycolysis)によって糖からエネルギーを取り出しATP を生成する
- 解糖系の各反応をエネルギー的観点から読み解く
- 解糖系で利用される糖はグルコースに限らない
- 解糖系の制御は三つの律速酵素に対する調節で行われる
TCA サイクルについて