脂肪酸合成が正常に機能するためにはアセチル CoA の輸送や厳密な制御が必須となります。ミトコンドリア内のアセチルCoAはクエン酸シャトルを介して輸送され、脂肪酸合成へ利用されます。この過程は運河をまたいで荷物を運ぶイメージでとらえるとわかりやすいです。アセチル CoA はミトコンドリアの内膜を透過することはできません。これは荷物がそのままでは運河を超えられないことと似ています。運河では船に乗せて荷物を運びますが、アセチル CoA はオキサロ酢酸を船代わりにしてミトコンドリアの内膜を透過します。
また、脂肪酸合成は ACC において AMPK やクエン酸による厳密な制御を受けています。脂肪酸の合成は薪の作り置きに例えられますが、その制御は薪が豊富な時に推進されるように判断され、薪が枯渇する場合やほかにエネルギーの需要が高まっている場合には停止されるように判断されます。この判断を受け取って脂肪酸合成の ON/OFF を主に担う酵素は アセチル CoA カルボキシラーゼ(ACC)となります。脂肪酸合成はアセチル CoA に炭酸を付加してマロニル CoA とし、脂肪酸 CoA と縮合させて伸長させていきます。この過程はアセチル CoA を薪と見立てると付加される炭酸は薪束に新たな薪を固定する杭のようなものと考えることができると思います。束ねてしまえば杭は不要になりますので除去され新しい薪束が完成します。ACC はこの杭を差し込む役割を担います。合成の ON/OFF は ACC の機能を止めることで新しい薪が薪束に固定できなくなり、経路が止まるイメージでとらえるとわかりやすくなるかもしれません。
この記事では作用機序を図解で詳しく解説します。
Contents
アセチル CoA の輸送
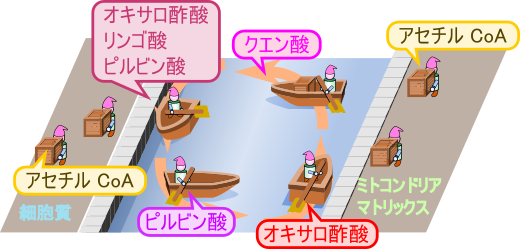
ミトコンドリア内膜を超えたアセチル CoA の輸送の概要
脂肪酸合成の記事でも紹介したとおり、脂肪酸合成は細胞質で行われます(詳細はこちら)。ところで、脂肪酸合成ではアセチル CoA がもととなり、マロニル CoA を消費して伸長反応が行われますが、マロニル CoA はアセチル CoA がカルボキシル化されて生成されます。結局のところ、脂肪酸合成はアセチル CoA を原料として行われます。
ところで、脂肪酸合成に利用するアセチル CoA はどこから供給されるのでしょうか?エネルギー源となる糖が不足すると β 酸化により脂肪酸が分解されますが、やがてエネルギーが充足するとこうして産生されたアセチル CoA が余剰となります。一方で、余剰のピルビン酸はピルビン酸デヒドロゲナーゼの作用により酸化的脱炭酸を受けてアセチル CoA に変換されます。こうして産生された余剰のアセチル CoA はエネルギーを貯蓄するために脂肪酸合成に利用されます。アセチル CoA が産生される反応経路はいずれもミトコンドリアのマトリックス内で行われますが、脂肪酸合成は上述の通り細胞質で行われます。ところが、ミトコンドリアの内膜は容易にはアセチル CoA を通すことはありません。したがってアセチル CoA をミトコンドリアのマトリックスから細胞質に輸送する必要があります。
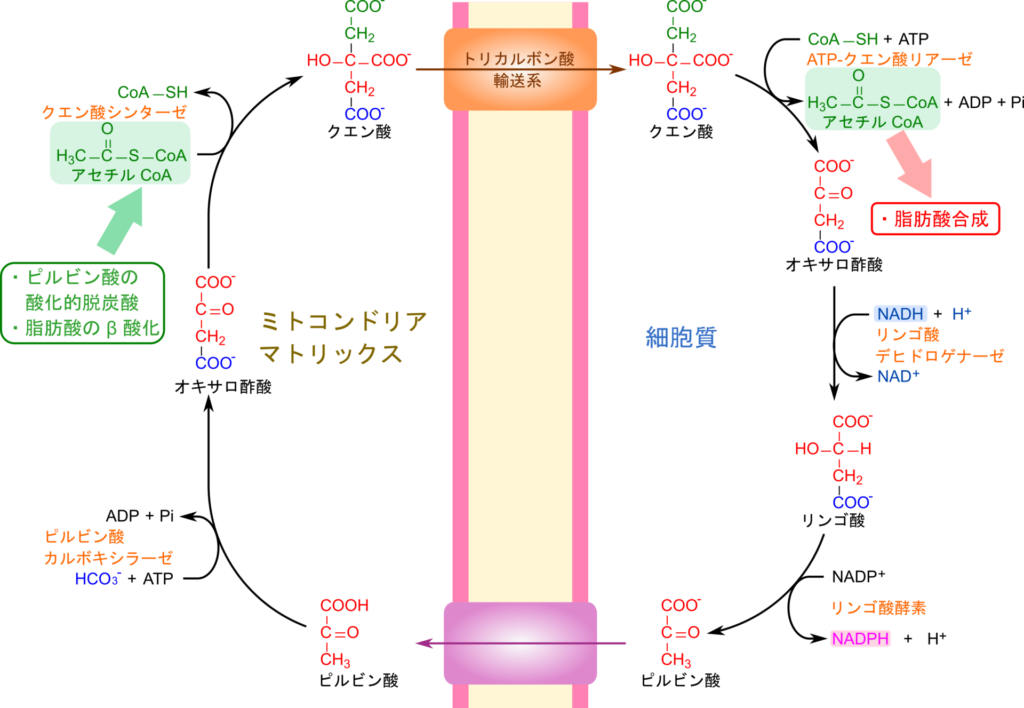
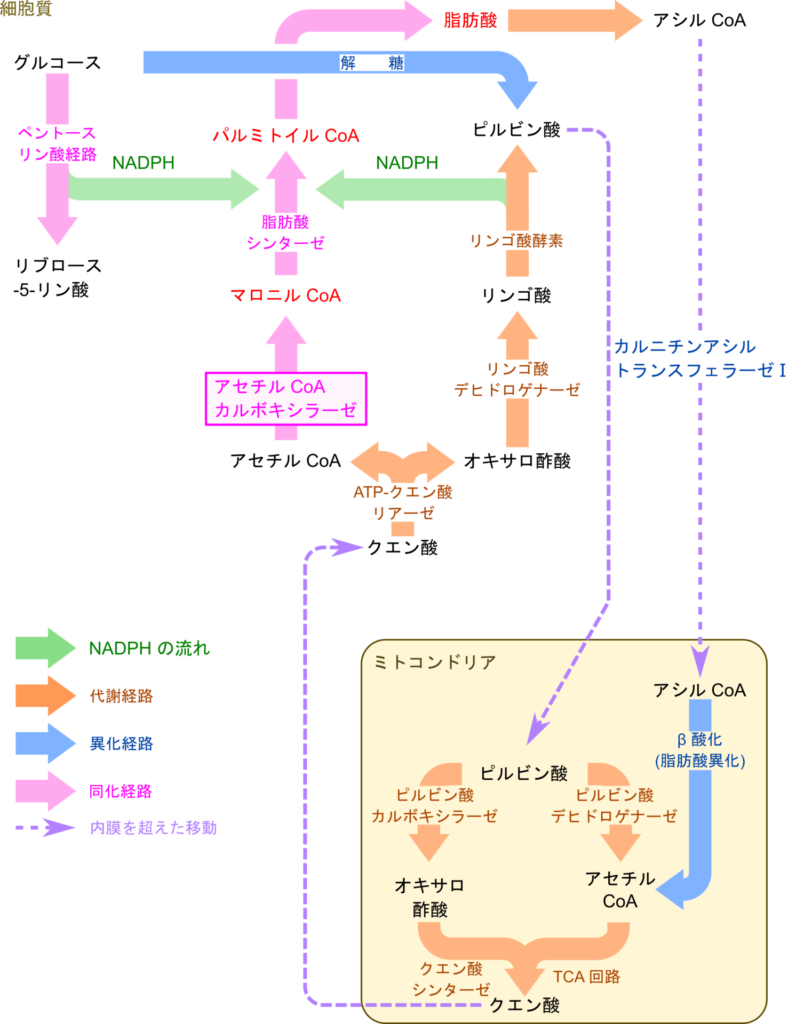
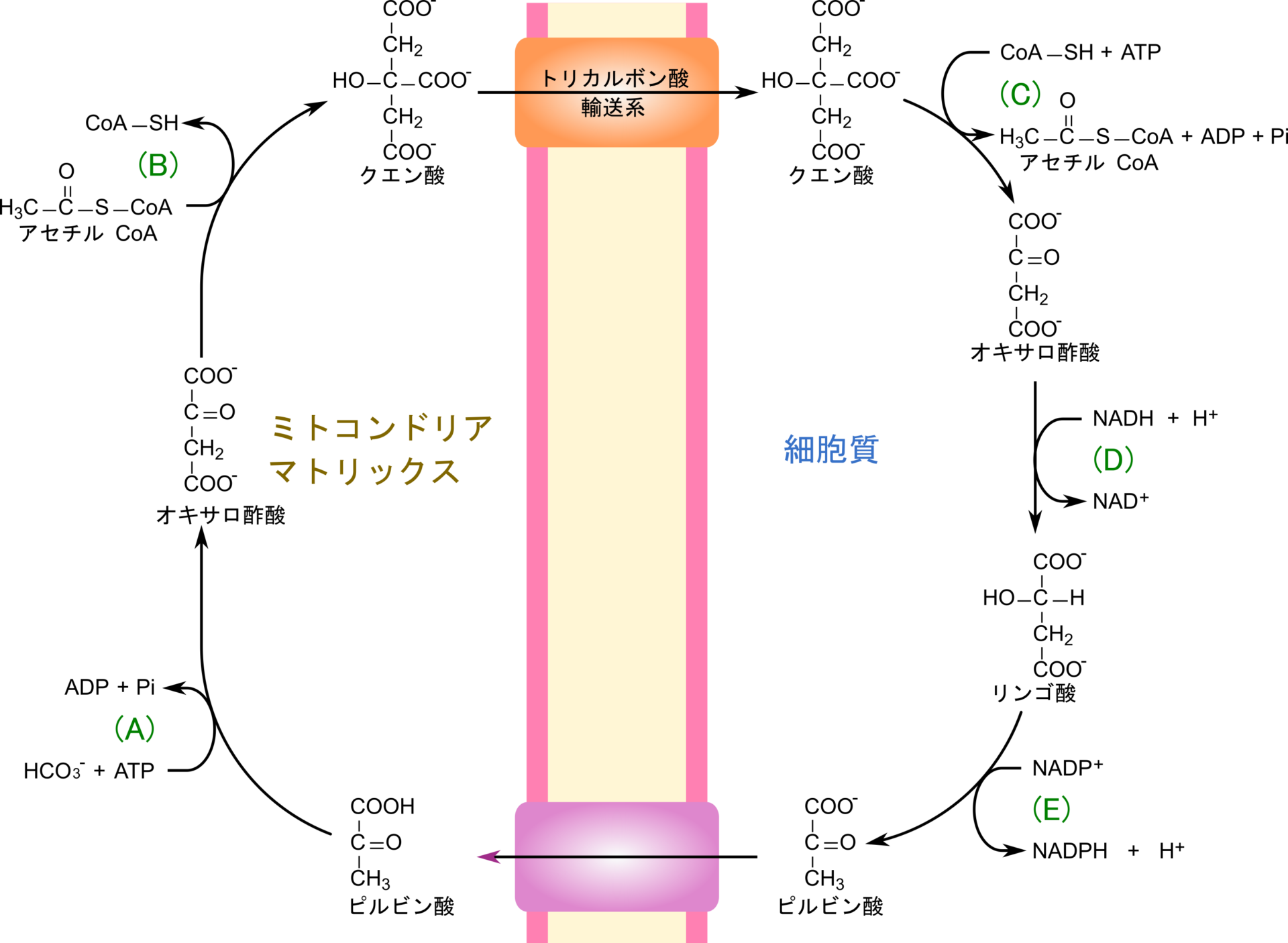
ミトコンドリアで生成されたアセチル CoA はクエン酸シンターゼによりオキサロ酢酸にアセチル基を渡してクエン酸に変換されます。生成されたクエン酸はトリカルボン酸輸送系によってミトコンドリア内膜を超えて細胞質へ輸送されます。この際に利用されるオキサロ酢酸は TCA 回路から供給されたり、ピルビン酸からピルビン酸カルボキシラーゼの作用により生成されて供給されます。その後 ATP クエン酸リアーゼの作用によりアセチル基が補酵素 A (CoA)に渡されてアセチル CoA が生成されます。このアセチル CoA が脂肪酸合成などに利用されるわけです。一方で、残ったオキサロ酢酸はリンゴ酸デヒドロゲナーゼの作用により NADH を消費して還元され、リンゴ酸に変換されます。さらにリンゴ酸はリンゴ酸酵素により NADP+ を消費して酸化を受けてピルビン酸に変換され、ミトコンドリア内に戻ります(図1)。この回路はクエン酸シャトル(citrate shuttle)と呼ばれています。
各反応の反応機構
ピルビン酸カルボキシラーゼによる反応の反応機構
ピルビン酸カルボキシラーゼはピルビン酸からオキサロ酢酸を生成する反応を触媒します。この反応はアセチル CoA からマロニル CoA を生成する反応と類似した反応機構で進行します(詳細はこちら)。
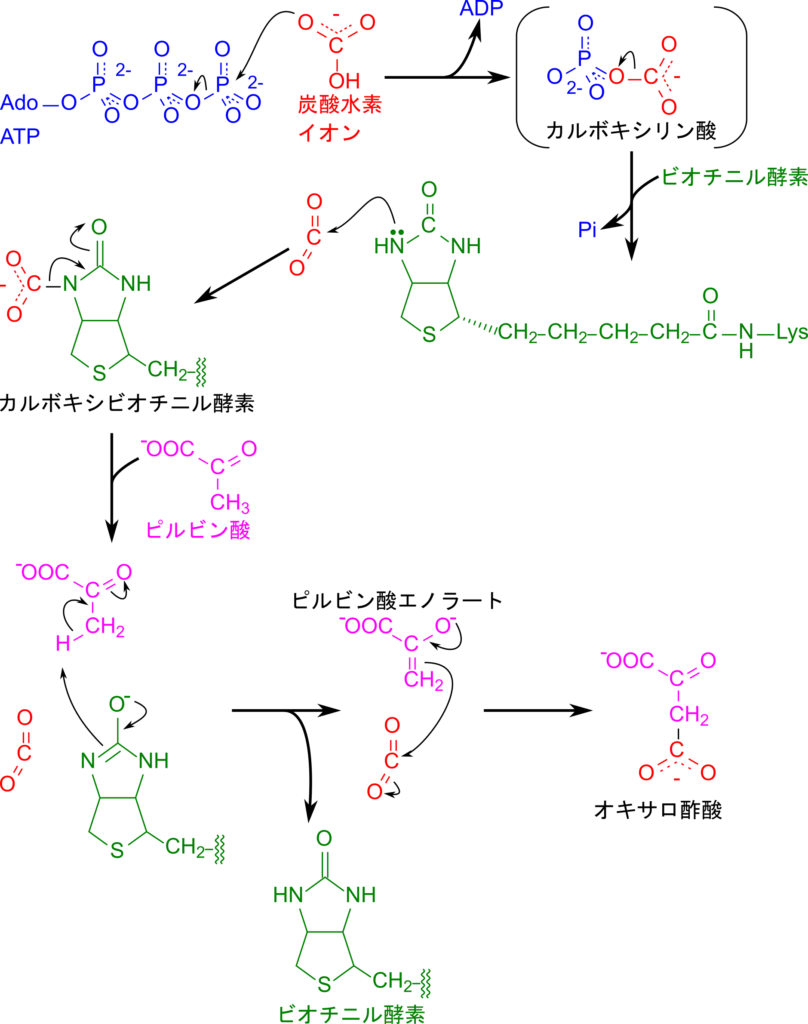
この反応はピルビン酸カルボキシラーゼにより触媒されますが、ビオチニル酵素(ビオチン+酵素、以下単にビオチンとします)を補酵素として利用し、二段階で進行します(図2)。
第1段階:HCO₃⁻ + ATP + ビオチン → カルボキシビオチン + ADP + Pi
第2段階:カルボキシビオチン + ピルビン酸 → オキサロ酢酸 + ビオチン
一段階目ではビオチンが炭酸を受け取ってカルボキシビオチンを生成する反応です。炭酸水素イオンが ATP を消費してリン酸化されてカルボキシリン酸中間体を生成します。カルボキシリン酸中間体は一過性の生成物で、すぐに炭酸とリン酸を放出して炭酸を生成し、この炭酸をビオチンの窒素原子が攻撃することでカルボキシビオチンを生成します(図2)。
二段階目の反応はピルビン酸のカルボキシル化反応です。カルボキシビオチニル酵素は炭酸を放出するとともに、ピルビン酸のメチル基からプロトンを抜き取ります。するとピルビン酸はエノラート(CH2=C(OH)- )に変換されますが、エノラートイオンは極めて不安定なため、二重結合の π 電子が炭酸の炭素を攻撃して結合を形成し、オキサロ酢酸を生成します。一方で、ビオチニル酵素はプロトンを受け取った時点で元に戻りますので触媒反応が完結することになります(図2)。
クエン酸シンターゼによる反応の反応機構
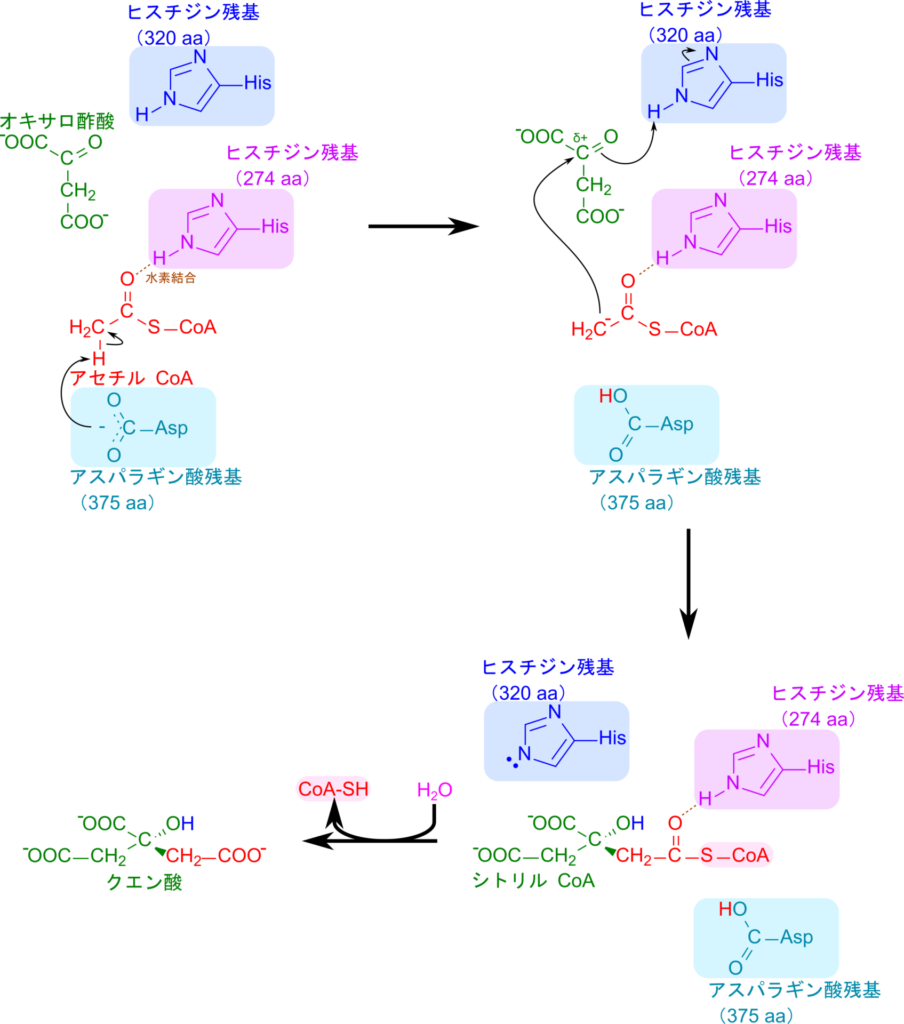
クエン酸シンターゼはオキサロ酢酸とアセチル CoA が縮合してクエン酸を生成する反応を触媒します。この反応ではクエン酸シンターゼのアスパラギン酸がアセチル CoA のメチル基からプロトンを抜き取ってアセチル CoA がエノラート中間体に変換されます。この時、ヒスチジン残基(274 His)がアセチル CoA のカルボニル基の酸素と水素結合を形成することでアセチル CoA が適正な位置に来るように固定しています。その後、エノラートとなったアセチル CoA のメチル基がオキサロ酢酸のカルボキシル基を攻撃して結合を形成するとともにヒスチジン残基(320 His)からプロトンを受け取ってシトリル CoA が生成されます。最後に CoA が加水分解により遊離してクエン酸が生成されます。
ATP-クエン酸リアーゼによる反応の反応機構
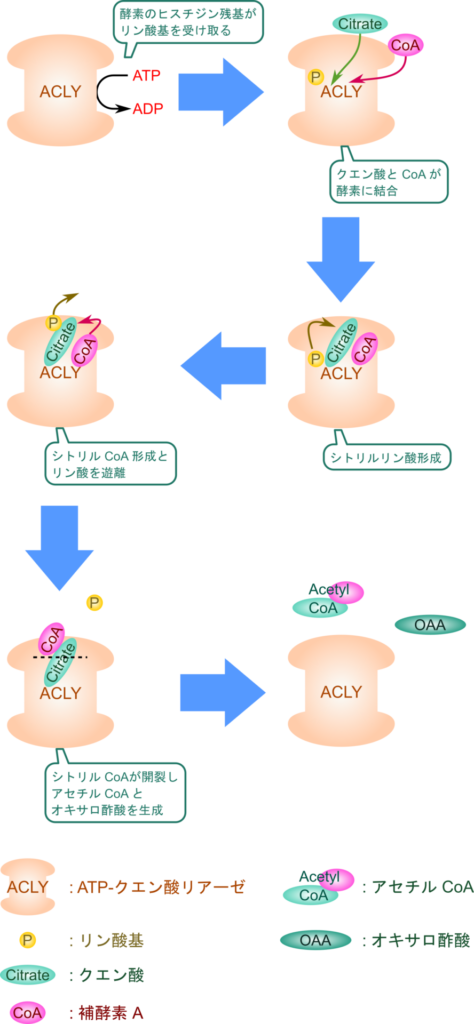
ATP-クエン酸リアーゼは ATP を消費してクエン酸からアセチル基を CoA へ転移する反応を触媒します。この反応では ATP-クエン酸リアーゼ(ATP-citratelyase;ACLY)のヒスチジン残基が ATP を消費してリン酸化され、クエン酸、CoA と順次結合します。次いでクエン酸がリン酸化を受けて活性化され、CoA のチオール基がリン酸基のリン原子を攻撃して入れ替わり、シトリル CoA が生成されます。最後にクエン酸部分が開裂してアセチル基が CoA とともに遊離し、残る部分がオキサロ酢酸として遊離します(図4)。
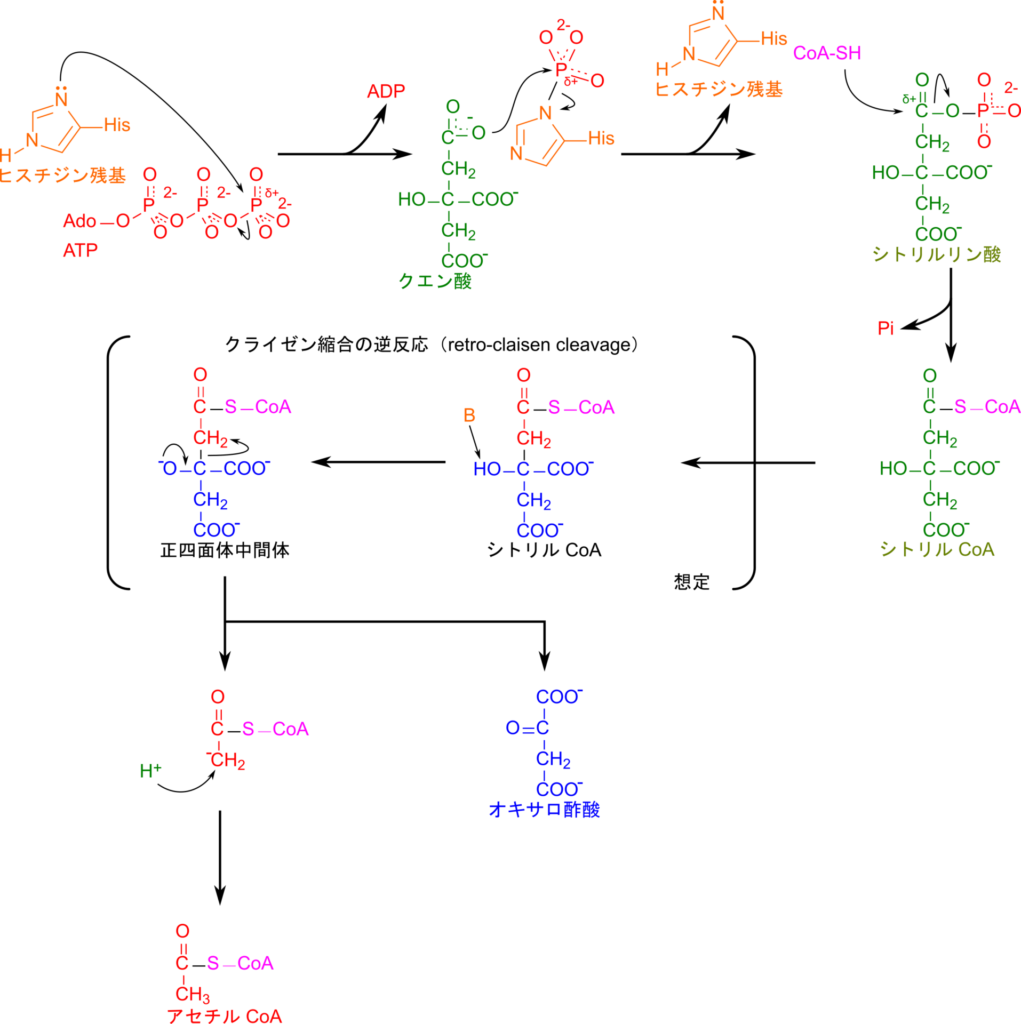
では化学的な観点から反応メカニズムを見ていきましょう。ATP のリンが酵素のヒスチジン残基から攻撃されてリン酸基がヒスチジン残基に転移し、ADP が遊離します。次に、クエン酸の末端カルボニル基がリンを攻撃してクエン酸にリン酸基が転移してシトリルリン酸が生成され、ヒスチジンは元に戻ります。リン酸基により活性化されたクエン酸のエステル結合が CoA のチオール基が攻撃して CoA が転移され、シトリル CoA が生成されます。シトリル CoA は開裂してオキサロ酢酸とアセチル CoA になりますが、この反応はクライゼン縮合の逆反応によって進行すると考えられています(図5)。生成されたオキサロ酢酸はリンゴ酸デヒドロゲナーゼの作用によりリンゴ酸に変換されます。この反応は単純な還元反応であり、NADH を消費します。
リンゴ酸酵素による反応の反応機構
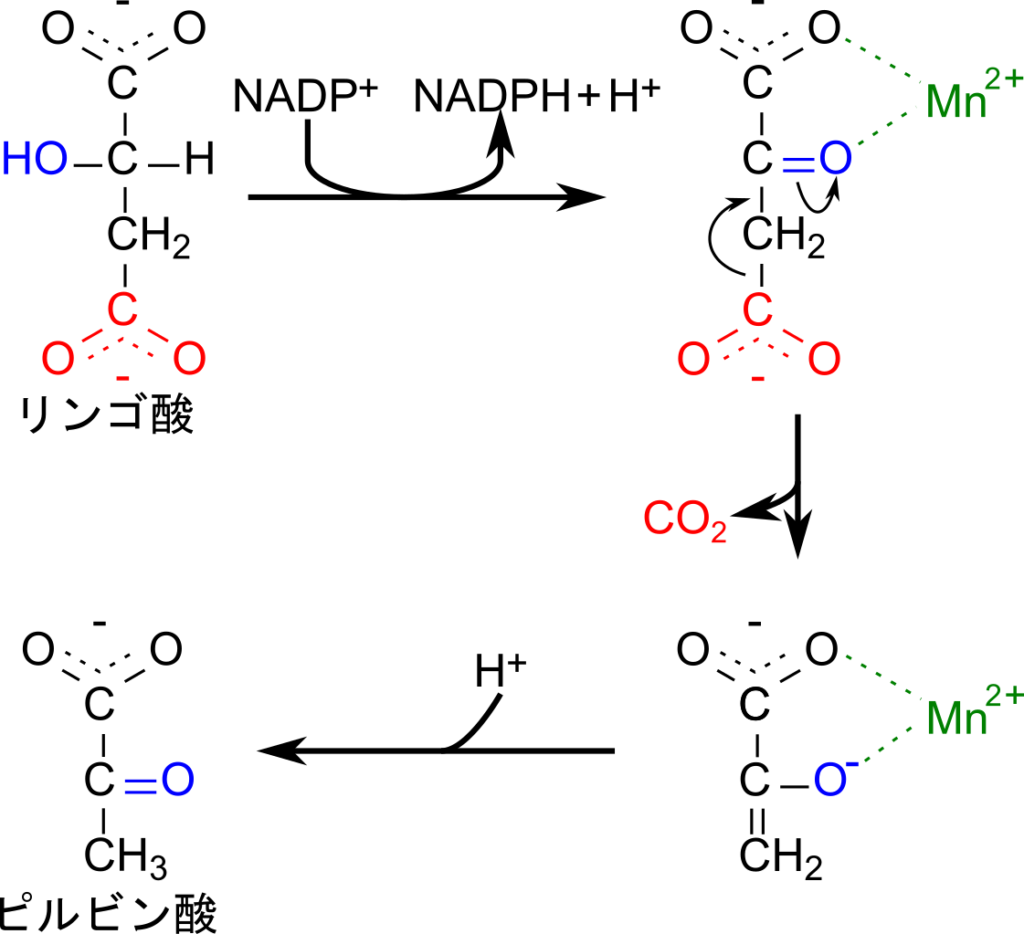
リンゴ酸酵素ではまず、リンゴ酸が酸化されてカルボニル基が生成されます。この時 NADP+ が消費されます。リンゴ酸酵素にはマンガンが内包されており、このマンガンがカルボニル基の酸素とカルボキシル基の酸素と水素結合することによりリンゴ酸を適正な位置に来るように固定します。その後、リンゴ酸の末端のカルボキシル基が炭酸として遊離すると残る部分はエノラート中間体を形成します。プロトンが供給されるとエノラート中間体はピルビン酸に変換されて遊離します(図6)。
脂肪酸合成と各代謝経路の関係
脂肪酸合成は各代謝経路と関連しあいながら進行します。脂肪酸合成に使用されるアセチル CoA はTCA 回路や β 酸化から供給されます。ただし、これらの反応経路はミトコンドリアのマトリックスで行われるため、アセチル CoA を(内膜を超えて)輸送するためにクエン酸に変換して輸送されます。この時利用されるオキサロ酢酸はピルビン酸に炭酸が付加されることで供給されます。一方でピルビン酸は解糖系から供給され、アセチル CoA の生成などに利用されます。このように、脂肪酸合成に利用されるアセチル CoA やピルビン酸などはエネルギーを生み出す経路から供給されます。
これらの分子は本来、TCA 回路で利用され、さらなるエネルギー生成に利用されるわけですが、エネルギーが充足すると不要となり、余剰となってしまいます。そこで、脂肪酸合成に利用することでこれらの分子を脂肪として保存します。なお、脂肪酸合成には NADPH が利用されますが、NADPH はペントースリン酸経路やリンゴ酸の酸化によって供給されます。このように、脂肪酸合成は余剰のエネルギーを無駄にすることなく保存する役割を担います。
脂肪酸合成の制御
脂肪酸合成の調整の概要
脂肪酸合成はエネルギーが充足した場合に余剰のアセチル CoA を貯蓄するために行われます。逆に、十分な脂肪酸が合成された場合は合成する必要がなくなるので脂肪酸合成は阻害されます。一方で β 酸化のような脂肪酸の酸化は脂肪酸合成が優位に進みだすことで阻害されることになります。
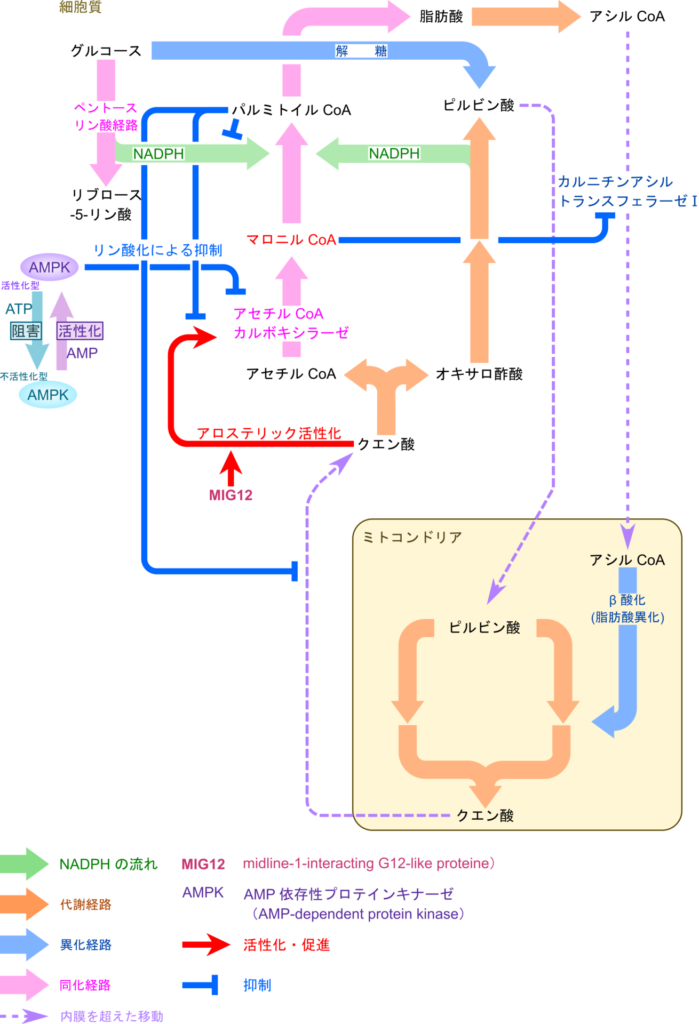
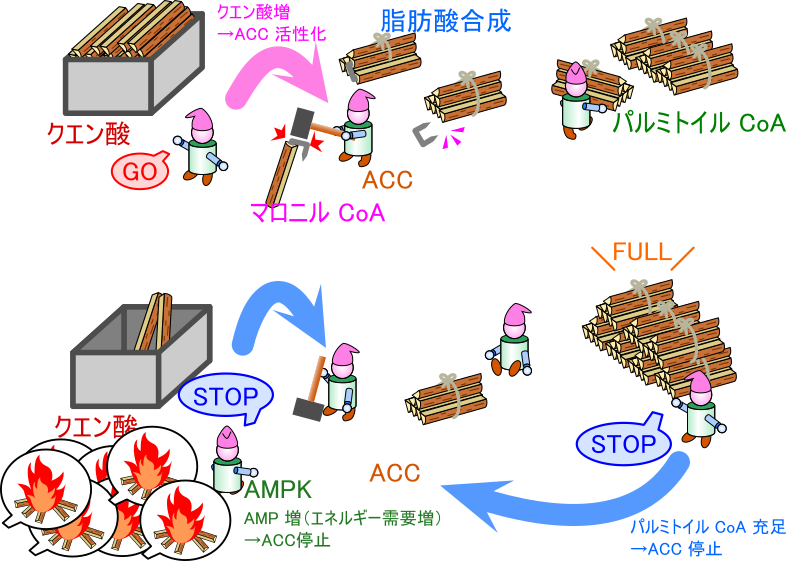
細胞質内のクエン酸はアセチル CoA カルボキシラーゼ(ACC)の活性に深く関与します。クエン酸は ACC をアロステリックに(活性部位と異なる位置に結合することにより)活性化します。この際、MIG12 はより低濃度のクエン酸で ACC 活性を引き出せるように作用します。さらに、パルミトイル CoA はクエン酸によるアロステリックな活性化を阻害することで、ACC の活性を阻害するとともに、クエン酸のミトコンドリアのマトリックスから細胞質への輸送を阻害することで ACC の活性化に不利に働くとも考えられます。クエン酸は図7で示すようにアセチル CoA と ATP が豊富な場合に供給量が増大します。したがってクエン酸濃度が増大している状況下ではエネルギー過剰の状態ですので脂肪酸合成を誘導しなければなりません。したがって ACC の活性は上昇して脂肪酸合成は活発に行われることになります。一方で、パルミトイル CoA が豊富になると十分な脂肪酸合成が行われたことを示します。従ってパルミトイル CoA は細胞質内のクエン酸濃度を低下させたり、その作用を打ち消すように働いてフィードバック阻害をもたらします(図8)。
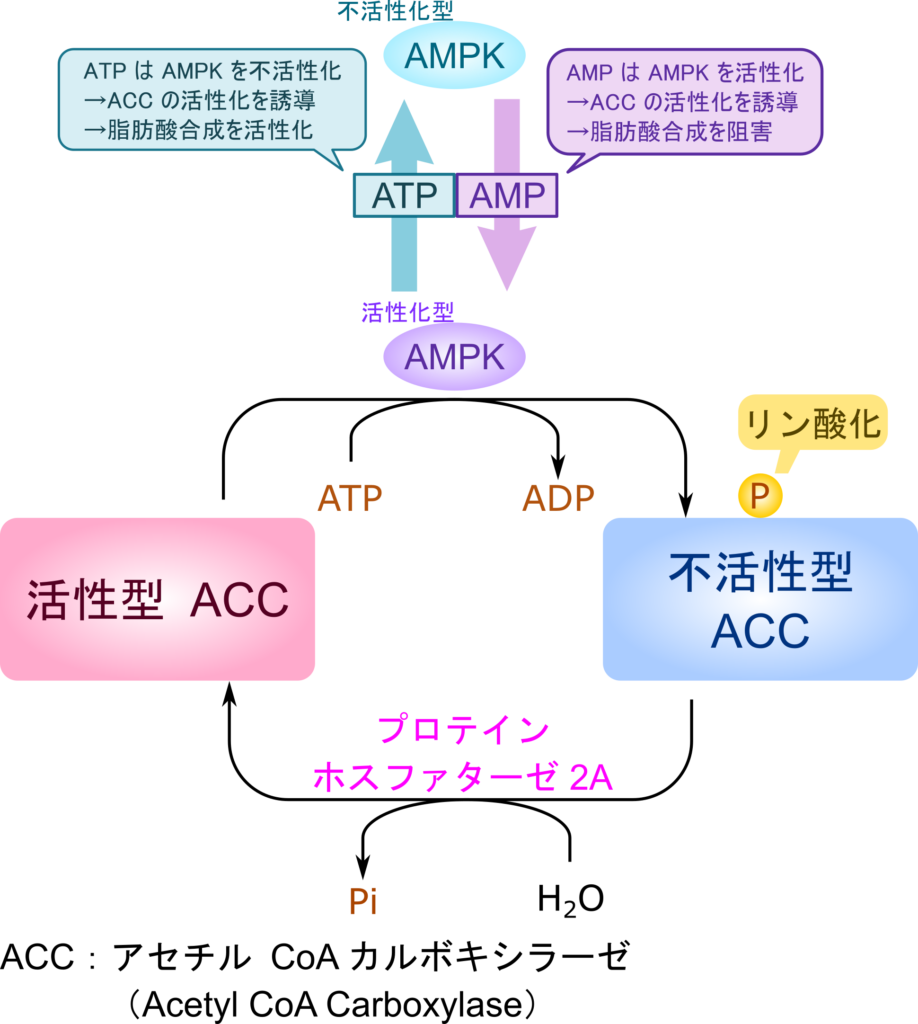
一方で AMP-依存性プロテインキナーゼ(AMPK)も ACC 活性を調整する重要な因子です。AMPK が機能すると ACC がリン酸化を受けて構造変化を引き起こし、不活性化型の ACC へ変化します。AMPK は AMP により活性化されて ACC 活性阻害作用をもたらすことになります。一方で ATP が AMPK に作用するとその活性が阻害されて ACC 活性阻害作用がなくなるため、ACC が機能することに有利に作用します。このように AMP のような低エネルギー状態を示す分子は ACC 活性を低下させる方向に、ATP のような高エネルギー状態を示す分子は ACC 活性を高める方向に作用します(図9)。
このように ACC は脂肪酸合成の律速段階(代謝経路の ON/OFF を運命づける段階)を触媒し、エネルギーが充足しているか否かに従って脂肪酸合成を ON/OFF する重要な酵素です。
一方でパルミトイル CoA はペントースリン酸経路からの NADPH の供給も阻害して、脂肪酸合成を抑制します。この作用も、十分な量のパルミトイル CoA が脂肪酸の十分な合成を示すシグナルと考えると理解しやすいことと思います(図8)。
マロニル CoA は脂肪酸合成が開始されたことを示すシグナルです。したがってマロニル CoA はカルニチンアシルトランスフェラーゼⅠの活性を阻害してアシル CoA のミトコンドリア内への輸送を阻害します。この作用は β 酸化の原料の供給を阻害することになりますので、脂肪酸の酸化を抑制するものです。
アセチル CoA カルボキシラーゼの活性化と阻害の分子機構
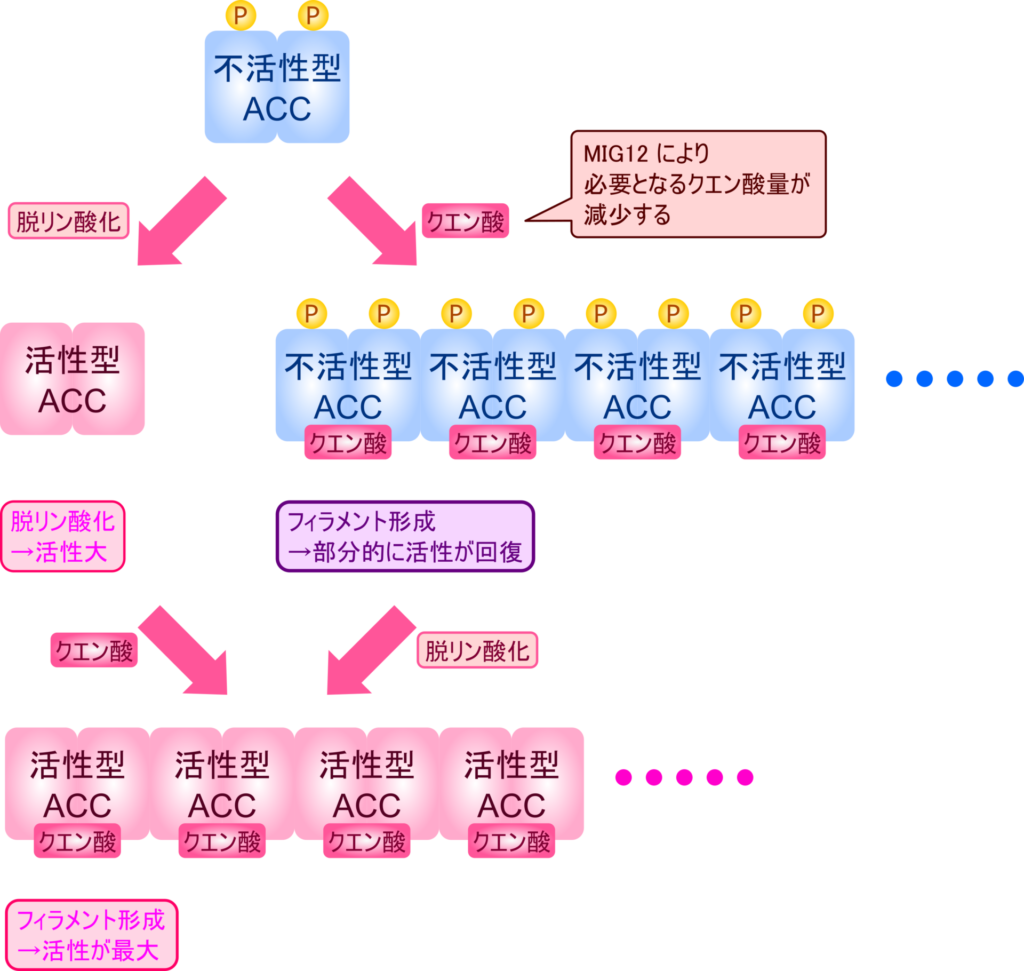
ACC は二種類の制御を受けることが知られています。一つは AMPK によるリン酸化の不活性化、もう一つはクエン酸によるアロステリックな活性化作用です。
AMPK は ACC の複数のセリン残基をリン酸化することにより ACC を不活性化します。一方でプロテインホスファターゼ 2A の作用により脱リン酸化を受けると ACC は活性を取り戻し、脂肪酸合成は活発に行われるようになります。
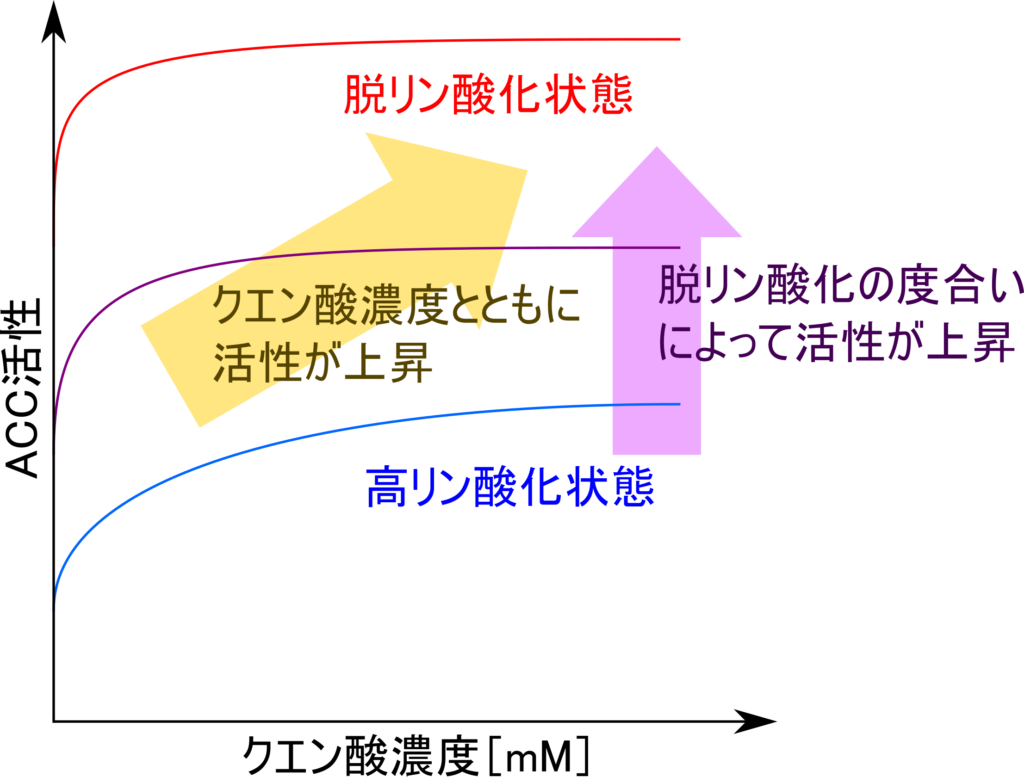
一方で、クエン酸が ACC にアロステリックに結合すると ACC の構造変化を引き起こして ACC の活性を上昇させます。ACC はホモ二量体を形成していますが、クエン酸により活性化を受けると多量体化を誘導してフィラメントを形成させます(図11)。ACC がフィラメントを形成するとその活性は上昇し、リン酸化された状態であっても ACC 活性が部分的に回復します(図10)。
さらに、脱リン酸化されて活性型に遷移した ACC はクエン酸の結合を受けてフィラメント化すると ACC 活性は最大となります(図10、図11)。
ホルモンによる脂肪酸合成の制御
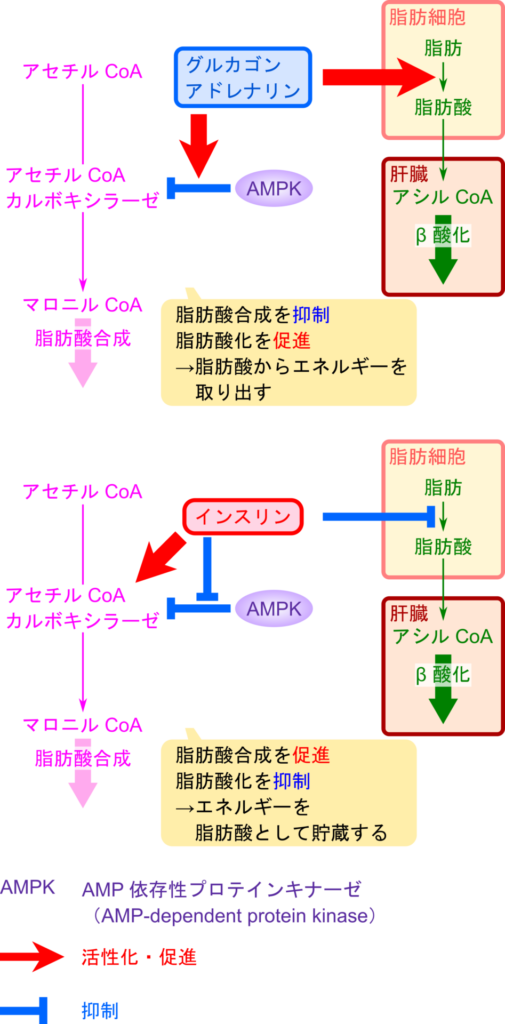
ACC はホルモンによる制御も受けることが知られています。
グルカゴンとアドレナリンは脂肪の利用を促すとともに脂肪酸合成を抑制します。これらのホルモンはトリアシルグリセロールから脂肪酸の遊離を誘導して脂肪酸の酸化を促進します。その一方で AMPK の活性を高めて ACC の作用を低下させ脂肪酸合成を阻害します。このようにグルカゴンとアドレナリンはエネルギーが不足している状況において脂肪の利用を促す一方で、脂肪酸合成を抑制して積極的に貯蓄していたエネルギーを利用するように体をコントロールします。
一方でインスリンは脂肪の利用を阻害して、脂肪酸合成を促進します。インスリンはトリアシルグリセロールから脂肪酸の遊離を阻害して脂肪酸の酸化を抑制します。一方で AMPK の作用を阻害し、ACC の抑制を阻害することで ACC 活性を誘導し、脂肪酸合成を誘導します。このようにインスリンはエネルギーが充足している状況では脂肪の利用を阻害し、脂肪酸合成を促して余剰のエネルギーを貯蓄するように作用します。
このように脂肪酸合成と脂肪酸酸化はホルモンによる制御も受けており、上述のフィードバック阻害、アロステリック活性化、リン酸化による阻害と合わせて厳密な制御を受けています。
練習問題
アセチルCoAのミトコンドリアマトリックスから細胞質への輸送について 正しい記述を1つ選べ。
脂肪酸合成の制御について正しい記述を1つ選べ。
ホルモンによる脂肪酸合成の制御について正しい記述を1つ選べ。
今回は脂肪酸合成の材料であるアセチル CoA がどのように輸送され供給されているのか、また、脂肪酸合成と脂肪酸酸化の位置づけと制御について解説しました。脂肪酸合成はエネルギーの貯蓄という生死にかかわる重要な過程です。生物にとってエネルギーは本来いつ手に入るかわからない側面があります。したがって余剰なエネルギーを無駄にすることなく貯蓄する脂肪酸合成経路は生物にとって非常に重要な経路です。一方で現代では様々な場面で注目される分野でもあり、その重要性は大きくなる一方です。このような脂肪酸合成がどのように制御されているのかという点はこれからも重要な研究分野であり、技術開発の最前線ともなりうる分野です。今回の記事では脂肪酸合成制御の基礎を提供するものであり、イメージがつかみやすいように心がけて作成しています。ぜひ、この記事を繰り返し読んで今後の活動の参考にしてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 190-207
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.440-476
- Fan, F., Williams, H. J., Boyer, J. G., Graham, T. L., Zhao, H., Lehr, R., … Meek, T. D. (2012). On the Catalytic Mechanism of Human ATP Citrate Lyase. Biochemistry, 51(25), 5198–5211. https://doi.org/10.1021/bi300611s (ピルビン酸輸送)
- Maier, T., Leibundgut, M., & Ban, N. (2008). The Crystal Structure of a Mammalian Fatty Acid Synthase. Science, 321(5894), 1315–1322. https://doi.org/10.1126/science.1161269 (脂肪酸合成)
- Chypre, M., Zaidi, N., & Smans, K. (2012). ATP-citrate lyase: A mini-review. Biochemical and Biophysical Research Communications, 422(1), 1–4. https://doi.org/10.1016/j.bbrc.2012.04.144(ピルビン酸輸送)
- Wei, J., & Tong, L. (2018). How Does Polymerization Regulate Human Acetyl-CoA Carboxylase 1? Biochemistry, 57(38), 5495–5496. https://doi.org/10.1021/acs.biochem.8b00881 (脂肪酸合成制御)