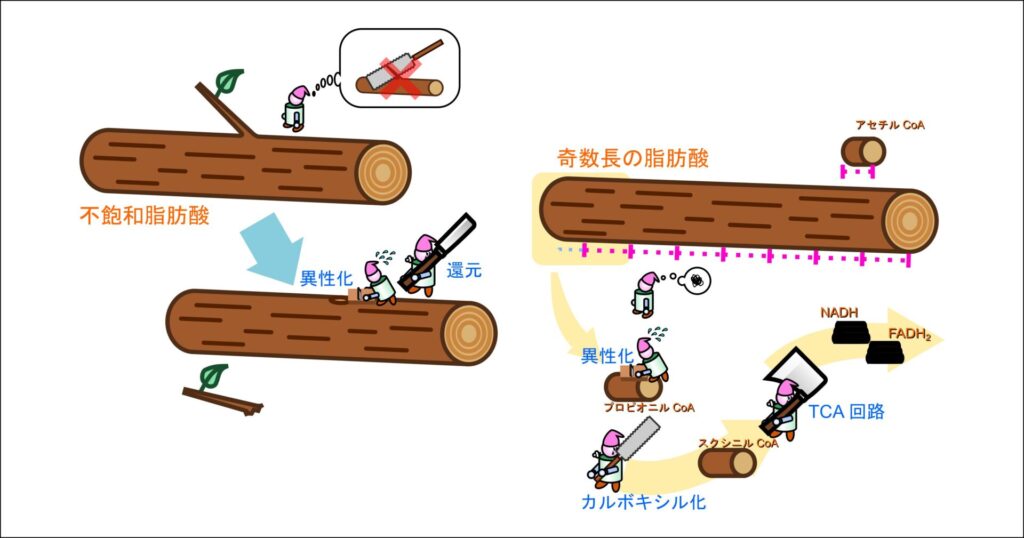
脂肪酸の酸化「β酸化」は偶数炭素の飽和脂肪酸を前提に語られることが多いですが、乳製品に含まれる奇数炭素脂肪酸や天然に豊富な不飽和脂肪酸も重要です。これらは通常経路だけでは処理できず、プロピオニルCoAの代謝や二重結合処理など特殊な補助反応を必要とします。以前に β 酸化を薪の作成に例えました。この概念に即して解釈すると二重結合の存在は枝分かれなどで切断が難しい箇所のある丸太を処理する工程に似ています。枝分かれは節があって固く、そのままでは処理が難しいので、枝を落として(還元して)カンナをかける(異性化する)などの下処理をしてから β 酸化に利用します。一方で奇数長の脂肪酸は長さが中途半端なので最後にのこる丸太が長くなります(プロピオニル CoA)。この場合も特別な処理行うことで燃料(NADH や FADH2)の賛成に利用されます。本記事ではこれらの反応経路について整理して解説します。
Contents
炭素数が奇数の飽和脂肪酸の酸化
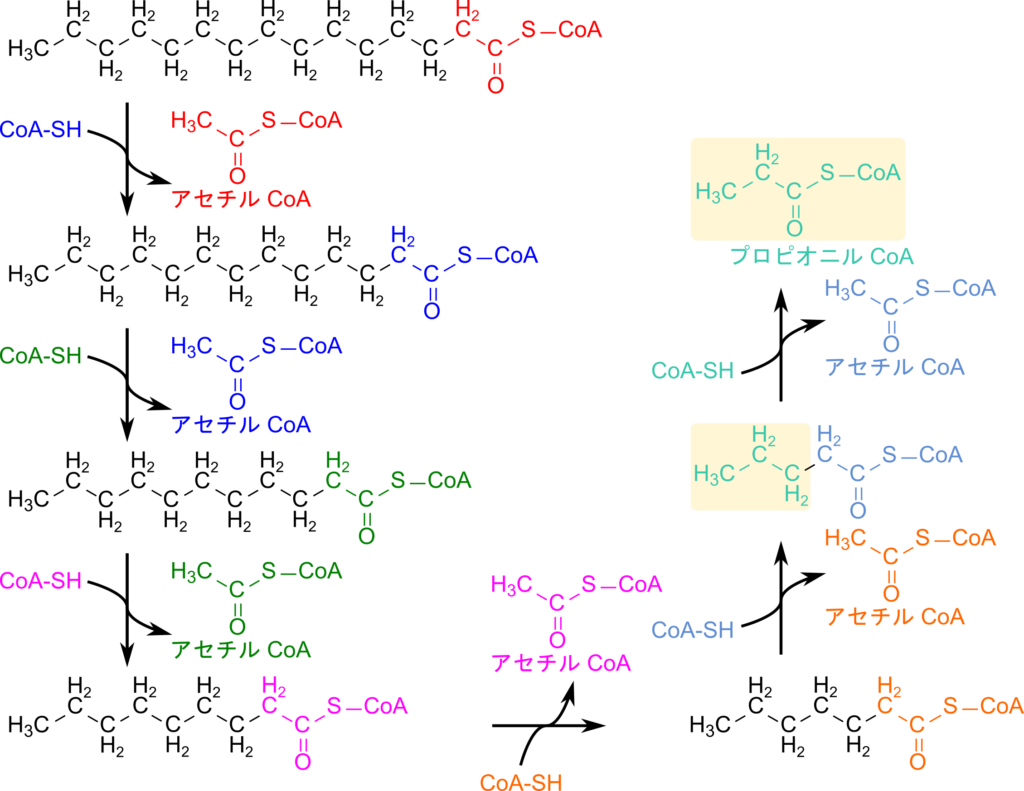
以前に紹介した β 酸化は炭素数が偶数の脂肪酸について紹介しています(詳細はこちら)。このため、順次酸化されていくと最後にはうまくアセチル CoA が残ります。脂肪酸の生合成は炭素2つ分ずつ伸長されるために多くの脂肪酸の炭素数は偶数であり、飽和脂肪酸の β 酸化は基本的にこの説明で理解できます。ところで、炭素数が奇数の脂肪酸は存在しないのでしょうか?実際には炭素数が奇数の飽和脂肪酸も乳製品などに含まれていることが知られています。炭素数が奇数の場合には最後にプロピオニル CoA(炭素数3)が残ります。この場合にはアセチル CoA のようにそのまま TCA 回路に利用することはできません。ここではプロピオニル CoA の処理を中心に、炭素数が奇数の飽和脂肪酸の酸化経路について解説していきます(図1)。
炭素数が奇数の飽和脂肪酸の酸化と偶数の飽和脂肪酸の酸化の違いは、最後に残るアシル CoA がプロピオニル CoA か、アセチル CoA かだけです。したがって、炭素数が奇数の飽和脂肪酸の酸化は、最後に残ったプロピオニル CoA の処理方法を理解することが重要となります。以下にプロピオニル CoA の処理過程を見ていきましょう(図1)。
プロピオニル CoA からスクシニル CoA への変換
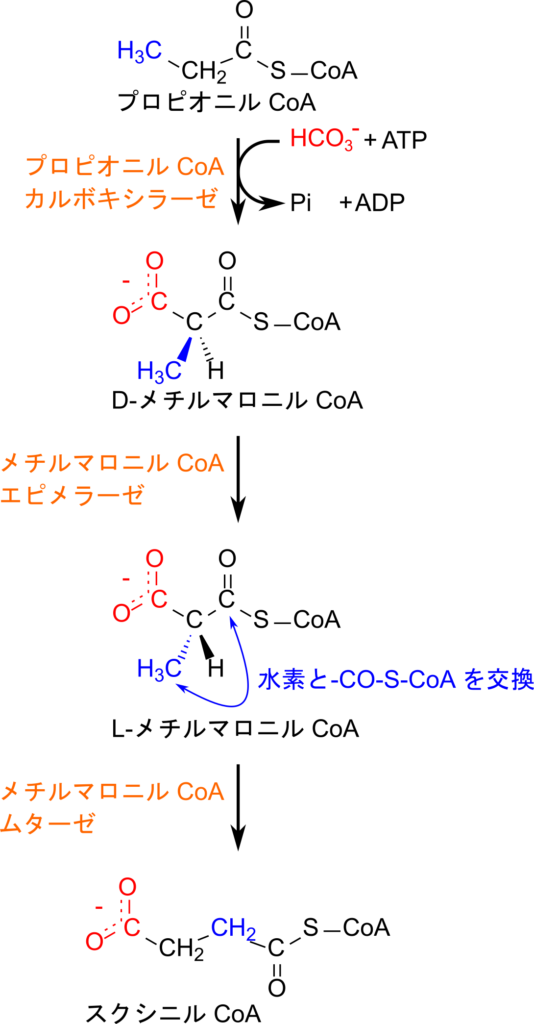
プロピオニル CoA はスクシニル CoA に変換されたのち、 TCA 回路に合流することで処理されます。スクシニル CoA とプロピオニル CoA の構造を比較すると、カルボキシル基(-COOH)が一つ足りないことに気づくと思います。したがって、カルボキシル基を付加するため、プロピオニル CoA はプロピオニル CoA カルボキシラーゼの作用により ATP を消費してカルボキシル化され、D-メチルマロニル CoA に変換されます。その後、メチルマロニル CoA エピメラーゼの作用を受けて異性化されて L-メチルマロニル CoA へ変換されます。この変換はその後に続くメチルマロニル CoA ムターゼの基質が L 体のみであるため、この酵素が利用可能なように異性化するステップです。ところで、メチルマロニル CoA ではカルボキシル基の位置がスクシニル CoA と異なっています。このため、メチルマロニル CoA ムターゼの作用によりメチル基が分子内転位されることで最終的にスクシニル CoA が生成されます。生成されたスクシニル CoA は TCA 回路に合流し処理されていきます。次に各ステップでポイントとなる点について詳細に見ていきましょう。
プロピオニル CoA のカルボキシル化の反応機序
プロピオニル CoA カルボキシラーゼによるカルボキシル化はビオチン(Biotin)を補酵素として利用します。ビオチンは以下のような構造をもつ補酵素です。ビオチンはカルボキシル基をいったん受け取ることで、カルボキシル基の移動仲介する事ができます。このため、カルボキシラーゼの補酵素としてよく活躍する分子です。
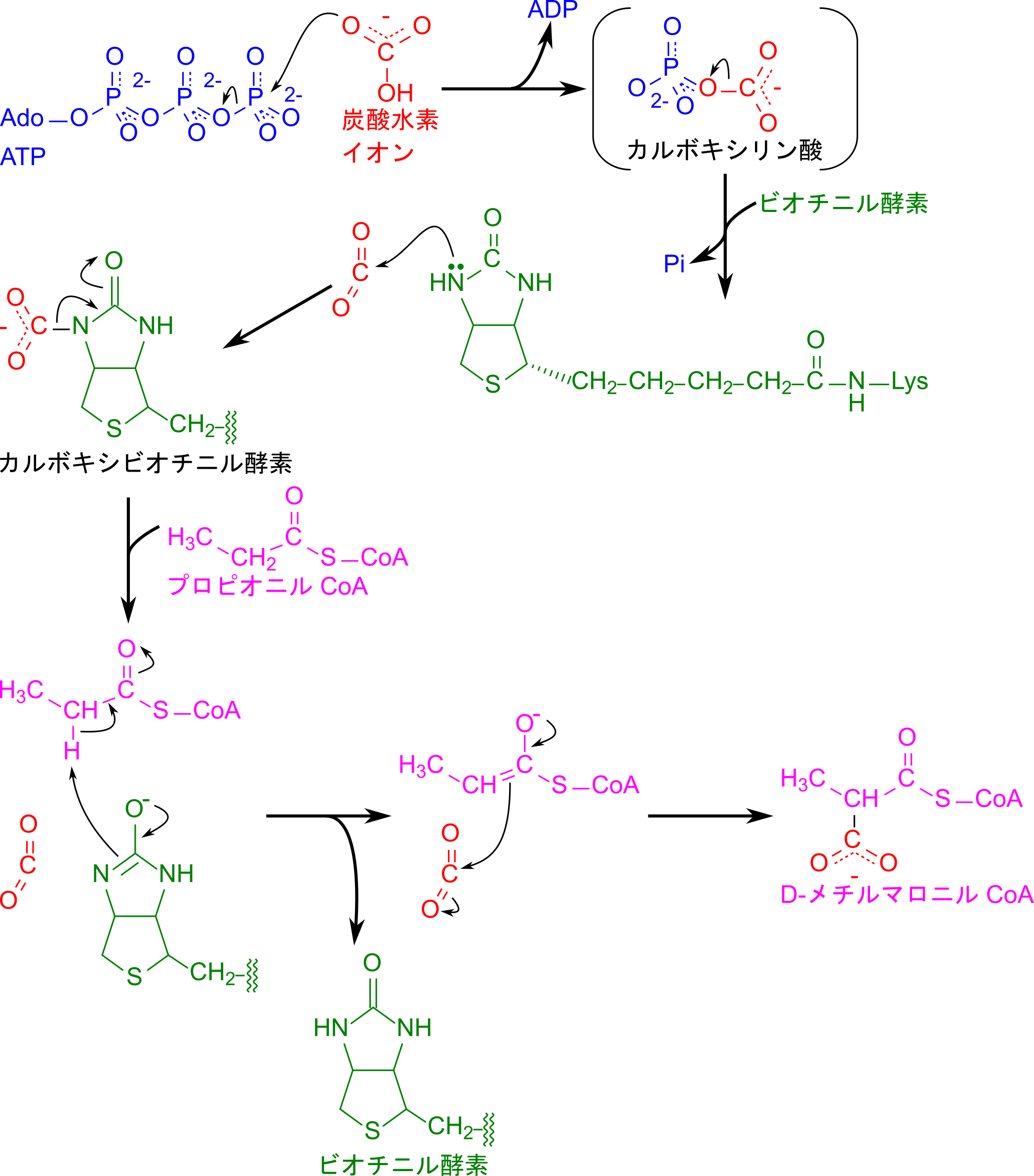
プロピオニル CoA のカルボキシル化では、ATPを利用して炭酸水素イオン(HCO₃⁻)が活性化され、カルボキシリン酸中間体が生成することから一連の反応が始まります。この活性化された炭酸はビオチンに転移され、カルボキシビオチンを形成します。続いて、ビオチンはプロピオニル CoA にカルボキシル基を転移し、その結果として D-メチルマロニル CoA が生成されます(図3)。その後、前述の通り D-メチルマロニル CoA は次の反応のため L 体へ異性化されます。
メチルマロニル CoA ムターゼによる L-メチルマロニル CoA の異性化
L-メチルマロニル CoA はメチルマロニル CoA ムターゼの作用によりメチル基が転移させられてスクシニル CoA を生成する過程を見ていきましょう。この過程はラジカル(不対電子をもつ分子)を介した珍しい過程です。メチルマロニル CoA ムターゼは補酵素としてコバラミン(cobalamin)を内包します。コバラミンのコリン環にはコバルトが含まれ、コバルト原子にはベンゾイミダゾール環とある種の原子団 X が結合しています。この原子団 X によってコバラミンの名称が変わります。なお、この X が 5′-デオキシアデノシンの場合には ビタミン B12 となります(メチルマロニル CoA ムターゼの場合にはビタミン B12 が補酵素となります;図4)。他の例は図4を参照して下さい。
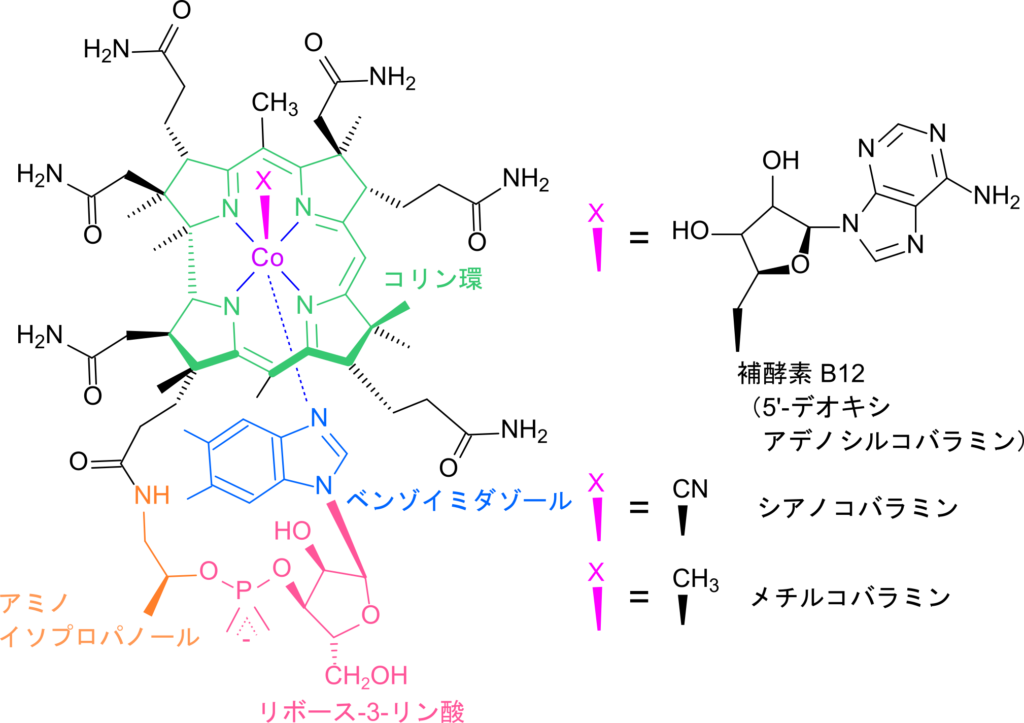
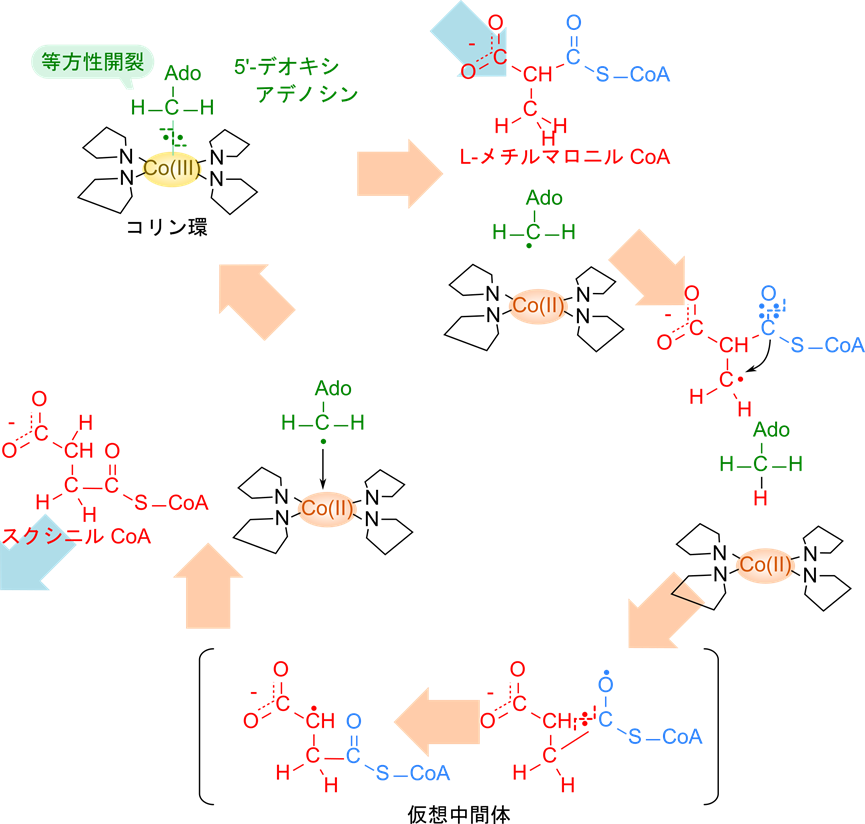
さて、コバルトは遷移元素ですので鉄などと同様に電子を一つ受け取って酸化型の Co(Ⅲ) から還元型の Co(Ⅱ) になることができます。この性質がラジカルを形成する鍵になります。まず、5′-デオキシアデノシンがコバルト原子から解離する際に等方性開裂(解離したそれぞれの分子に電子が一つずつ分配される開裂; ホモリシス開裂ともいいます)することで、デオキシアデノシン部分はラジカルとなります。このラジカルが L-メチルマロニル CoA のメチル基から水素(と電子一つ)を抜き取ることでメチル基上に不対電子を作って、ラジカル中間体を形成します。その後、不対電子を持つメチル基が再配置されることでスクシニル CoA が生成されます(この部分は仮説を図5に示します)。一方でスクシニル CoA の生成に伴って生成されたデオキシアデノシンラジカルはコバルトと再度結合して元に戻ります(図5)。
不飽和脂肪酸の酸化
これまでは飽和脂肪酸の酸化について見てきました。では、不飽和脂肪酸のように二重結合を含む脂肪酸の酸化はどうなるのでしょうか?不飽和脂肪酸の酸化ではもともと持っているシス型の二重結合がアシル CoA デヒドロゲナーゼによる二重結合の導入やエノイル CoA ヒドラターゼによる水の付加などを妨害してしまうため特別な処理が必要となります。不飽和脂肪酸の酸化は基本的な機序は理解されているものの、二重結合が複数含まれる場合や二重結合の位置によっては特殊なケースも知られており、詳細な機構については研究が続けられている分野でもあります。ここでは最も基本的な奇数位に二重結合がある場合と偶数位に二重結合がある場合について議論していこうと思います。
奇数位に二重結合がある場合の酸化
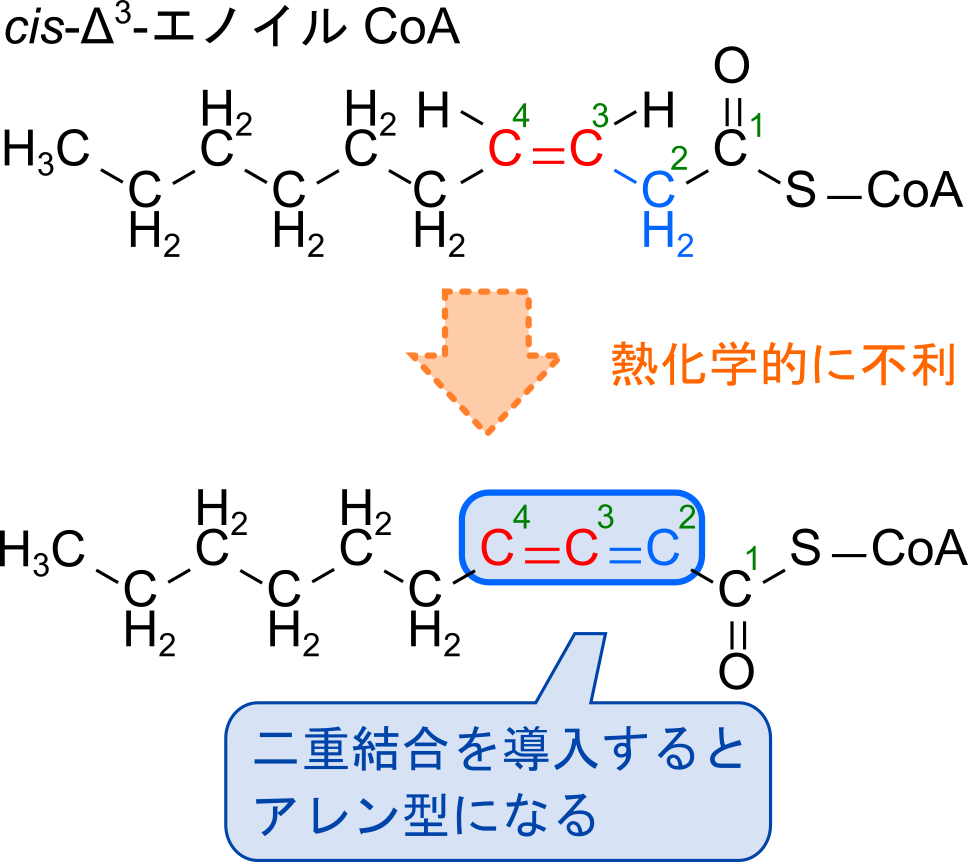
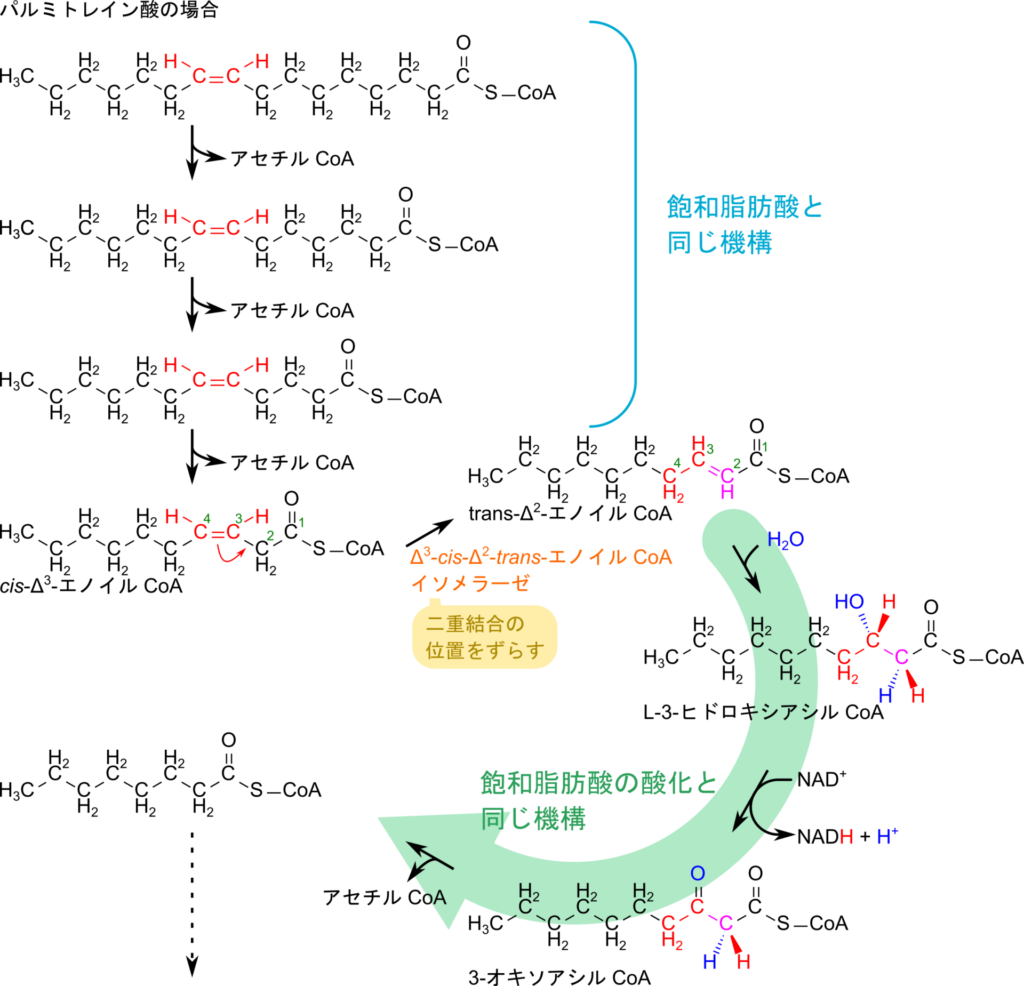
パルミトレイン酸を例に見ていきましょう。パルミトレイン酸では途中までは飽和脂肪酸と同じように酸化が進行していきます。ところが4サイクル目の β 酸化では3位に二重結合があるため2位に二重結合を導入するとアレン型構造(-C=C=C-)をとることになります。このアレン型構造が問題で、立体構造のいびつさや安定した電子配置が取れないため、アレン型を生成する反応は非常に不利となり、二重結合が導入できません(図6)。また、天然の不飽和脂肪酸は多くが cis 型をとります(図6)。アシル CoA の酸化では、trans 型の分子が中間体として生成されるわけですからこの点も解消する必要があります。この二つの問題は Δ3-cis-Δ2-trans-エノイル CoA イソメラーゼによって解消されます。この酵素は 3-4 位間にある二重結合を 2-3 位間に移動させると同時に、cis 体を trans 体に変換する活性を持っています。この酵素のおかげで不飽和脂肪酸の酸化で生じた cis-Δ3-エノイル CoA は trans-Δ2-エノイル CoA へ変換されます。この後は通常の β 酸化と同様の経路をたどります(図7)。
ところで、飽和脂肪酸の酸化では二重結合の導入に伴い FADH2 が産生されて電子伝達系で処理されることにより 1.5ATP が生成されます。ところが、不飽和脂肪酸の二重結合を含む部分の酸化では、異性化により trans-Δ2-エノイル CoA を生成するため、FADH2 の生成は伴いません。この分、生成される ATP の分子数が同じ長さの飽和脂肪酸と比べると少なくなりますので注意してください(少なくなるのは二重結合を含む箇所の酸化ステップだけです。ほかの部分は飽和脂肪酸の時と同じです)。脂肪酸は高度に還元されているために酸化することでエネルギーが得られることを思い出してください。不飽和脂肪酸は二重結合を含みますが、このことはそれだけ酸化されていることを意味します。つまり不飽和脂肪酸では飽和脂肪酸よりも酸化されている分得られるエネルギーが減ると理解する事もできます。
偶数位に二重結合がある脂肪酸の酸化
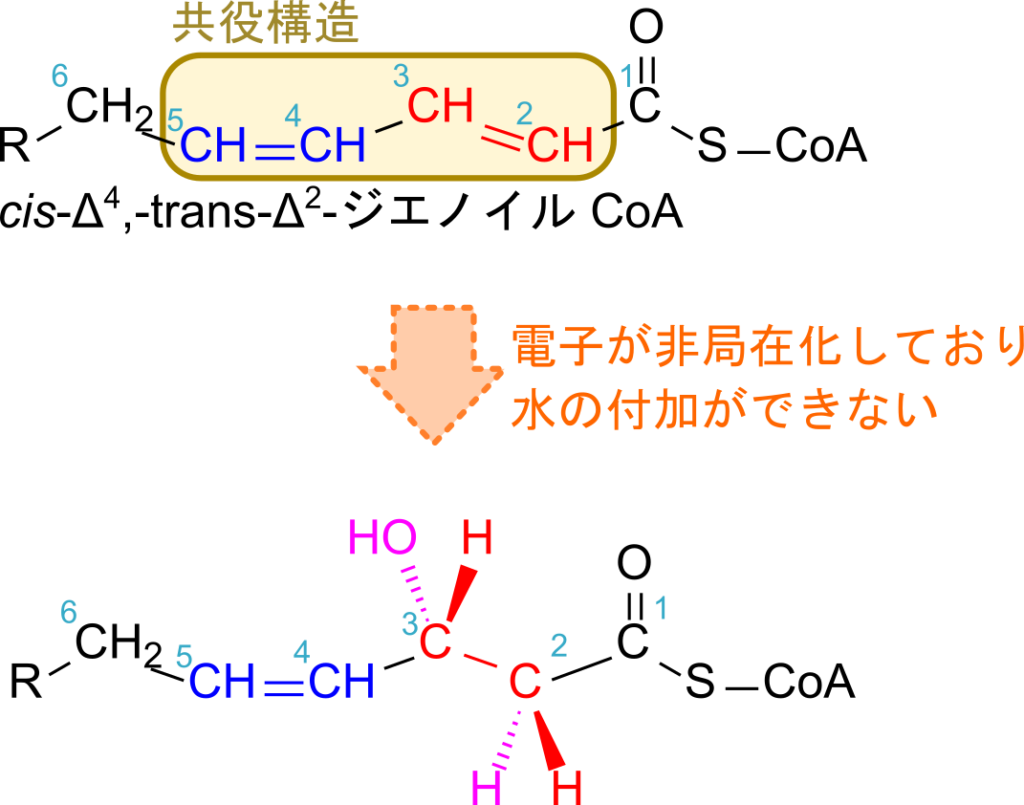
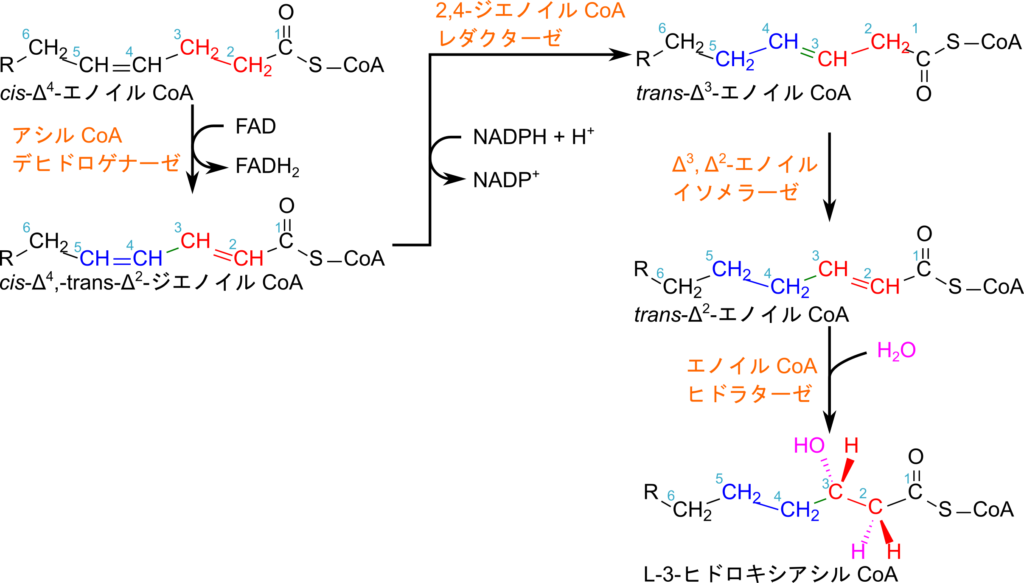
偶数位に二重結合がある場合、β 酸化が進んでいくといずれ cis-Δ4-エノイル CoA が生成されます。ここでアシル CoA デヒドロゲナーゼが作用すると cis-Δ2, trans-Δ4-ジエノイル CoA が生成されます。この分子は共役構造(-C=C-C=C-)を持っていますが、この構造は π 電子が広範囲に分布するため安定な構造です。この安定性のため、通常の β 酸化のように水の付加をしようとすると不安定化してしまうことになり、熱化学的に不利となるために水の付加反応がうまく進行しません(図8)。そこで、2,4-ジエノイル CoA は Δ3-エノイル CoA に変換して処理されます。
cis-Δ2, trans-Δ4-ジエノイル CoA は 2,4-ジエノイル CoA レダクターゼの作用により、trans-Δ3-エノイル CoA に変換されます。この反応は還元反応になりますので(二重結合が一つ減ります)、NADPH が消費されて、NADP+ が生成されます。trans-Δ3-エノイル CoA に変換されると Δ3, Δ2-エノイル CoA イソメラーゼの作用によって trans-Δ2-エノイル CoA が生成されます。なお、この酵素はシス体もトランス体も基質として利用可能です。ここまでくると、通常の β 酸化と同様で L-3-ヒドロキシアシル CoA が生成され、酸化過程が進んでいきます(図9)。
超長鎖脂肪酸の処理
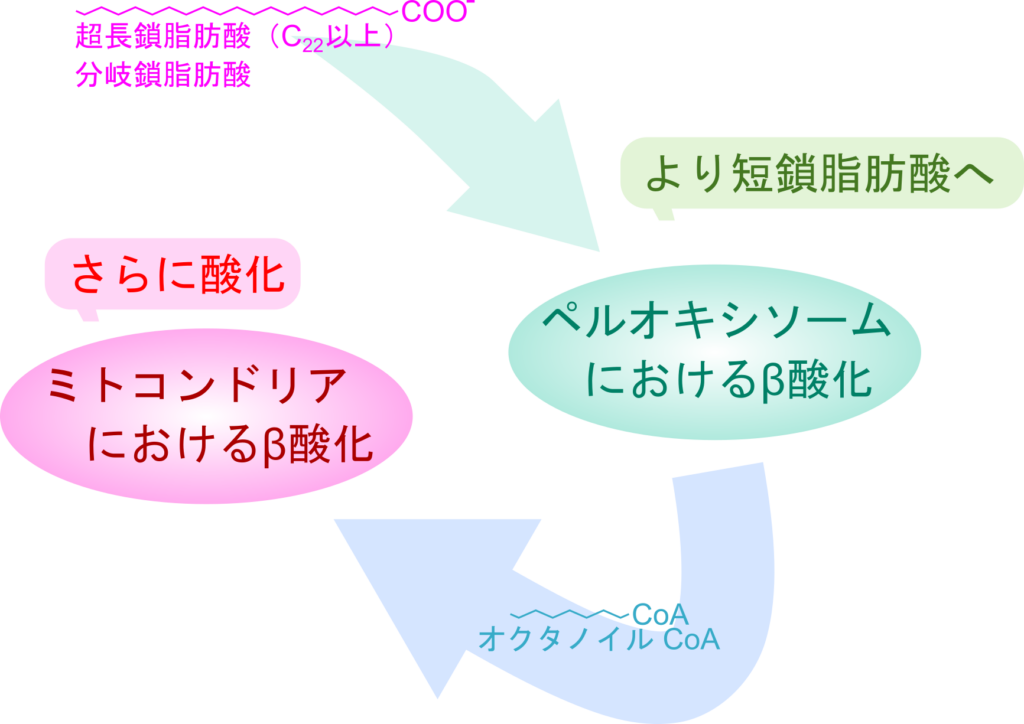
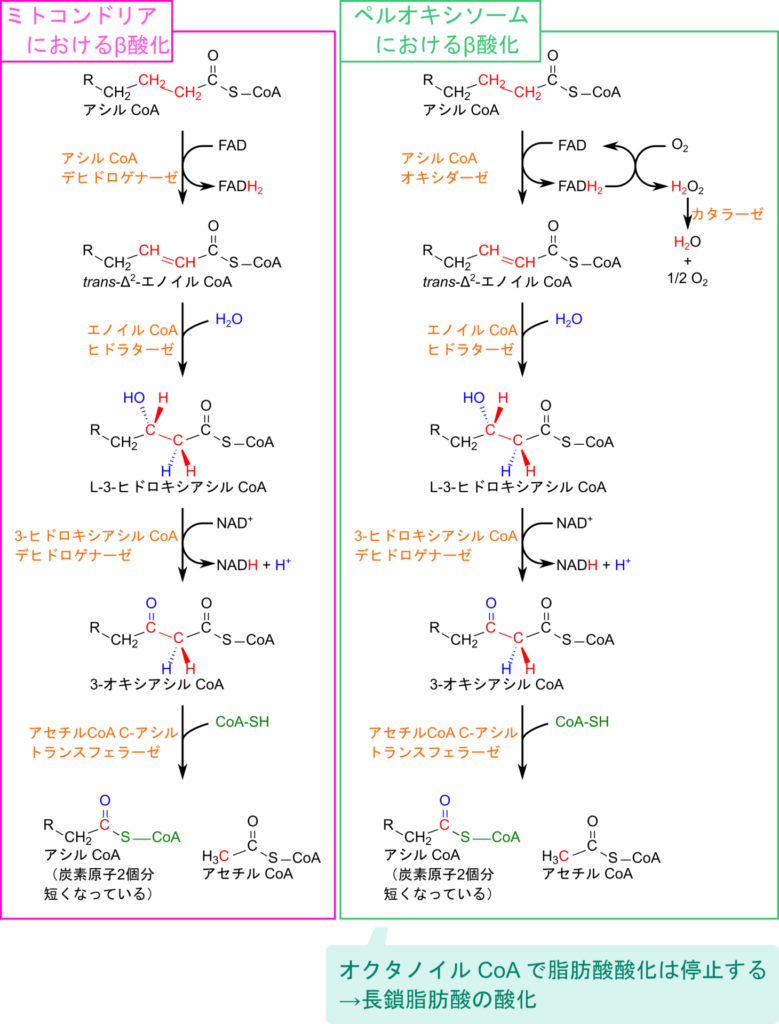
超長鎖脂肪酸(炭素数22以上)の脂肪酸はミトコンドリア外膜を超えて輸送することができません。そこで、これらの脂肪酸の処理はミトコンドリアとは異なる細胞小器官であるペルオキシソーム(peroxisome)で行われます。ペルオキシソームにおける脂肪酸の酸化ではオクタノイル CoA(炭素数 8)まで進行します。つまり、ペルオキシソームの役割はミトコンドリアでの酸化が難しいような非常に長い脂肪酸を酸化して中鎖脂肪酸程度まで短くすることにあります。このようにしてペルオキシソームはミトコンドリアで効率的に利用できる基質を与えます(図10)。
ペルオキシソームにおける β 酸化は基本的にミトコンドリアにおける酸化過程と同様ですが、FADH2 の処理で相違点があります。ミトコンドリアでは生成された FADH2 は電子伝達系で処理されますが、ペルオキシソームでは FADH2 に捕捉された電子は酸素に渡されて過酸化水素を生成し、カタラーゼの作用により水と酸素に分解されます(図11)。このため、ペルオキシソームのβ酸化はATPを直接生み出さず、むしろミトコンドリアにおける β 酸化に適した基質供給が主な役割となっています。
練習問題
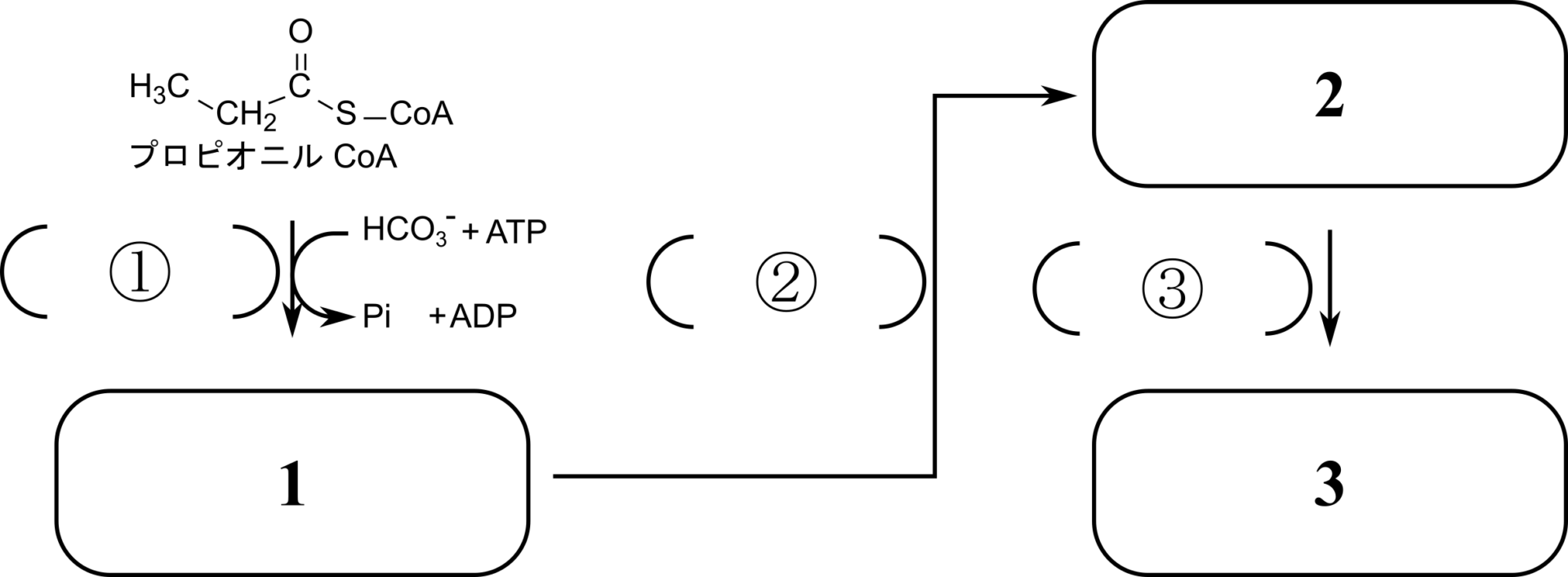
問 1-1.図の1~3に当てはまる構造を以下から選べ
問 1-2.図の①~③に当てはまる酵素名を以下から選べ
今回は、炭素数が奇数の脂肪酸や不飽和脂肪酸の酸化について紹介しました。脂肪酸は二重結合の数や位置によって多様なバリエーションがあり、それに応じて酸化経路も異なります。ここでは基本的な例に絞って解説しましたが、実際には現在も研究が進められている領域です。
一見単純に見える脂肪酸の酸化ですが、その仕組みを深く理解することで、生化学の奥深さを垣間見ることができるでしょう。興味を持った方は、今回紹介した以外の脂肪酸の酸化についても調べてみてはいかがでしょうか。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 190-207
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.440-476
- Miinalainen, I. J., Schmitz, W., Huotari, A., Autio, K. J., Soininen, R., Van Themaat, E. V. L., … Hiltunen, J. K. (2009). Mitochondrial 2,4-dienoyl-CoA reductase deficiency in mice results in severe hypoglycemia with stress intolerance and unimpaired ketogenesis. PLoS Genetics, 5(7). https://doi.org/10.1371/journal.pgen.1000543
- Shoukry, K., & Schulz, H. (1998). Significance of the reductase-dependent pathway for the β-oxidation of unsaturated fatty acids with odd-numbered double bonds. Journal of Biological Chemistry, 273(12), 6892–6899. https://doi.org/10.1074/jbc.273.12.6892
- Zhang, D., Yu, W., Geisbrecht, B. V., Gould, S. J., Sprecher, H., & Schulz, H. (2002). Functional characterization of Δ3,Δ2-enoyl-CoA isomerases from rat liver. Journal of Biological Chemistry, 277(11), 9127–9132. https://doi.org/10.1074/jbc.M112228200
- Cuebas, D., & Schulz, H. (1982). Evidence for a modified pathway of linoleate degradation. Metabolism of 2,4-decadienoyl coenzyme A. Journal of Biological Chemistry, 257(23), 14140–14144. https://doi.org/10.1016/S0021-9258(19)45356-8