アミノ酸の異化は「炭素骨格」と「アミノ基」に分けて理解すると理解しやすくなります。特にアミノ基の異化では有害なアンモニアが生成されますが、生体は巧妙に無毒化して尿素として排泄します。本記事ではアミノ基の異化経路だけでなく、窒素原子を安全に運搬して排泄する仕組みをわかりやすく解説します。
Contents
アミノ基の排泄 概要
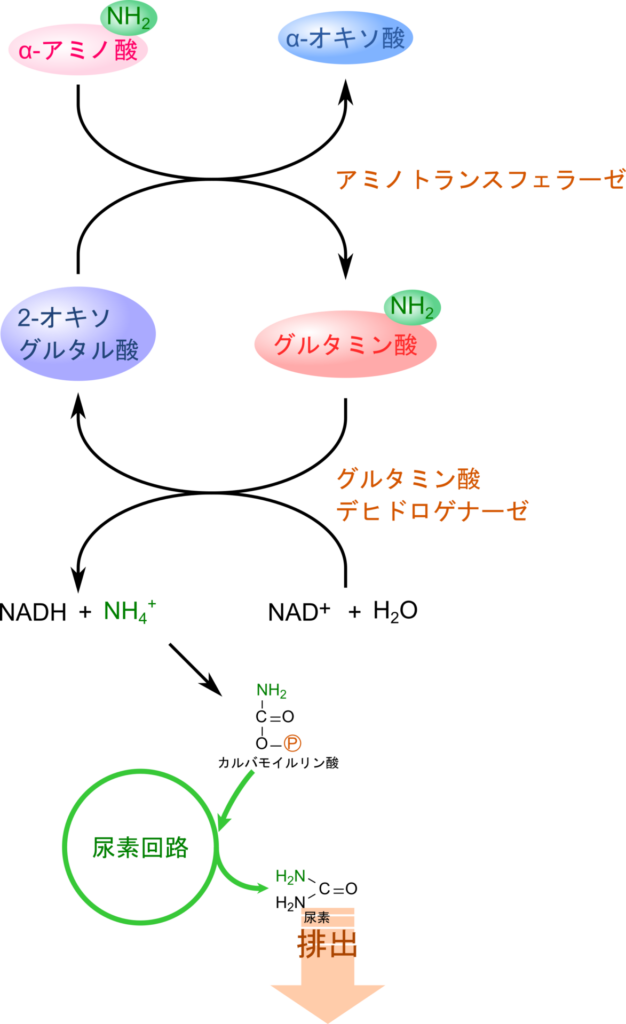
不要になったり、エネルギー源として利用されるアミノ酸は、肝臓で異化され、分解されます。
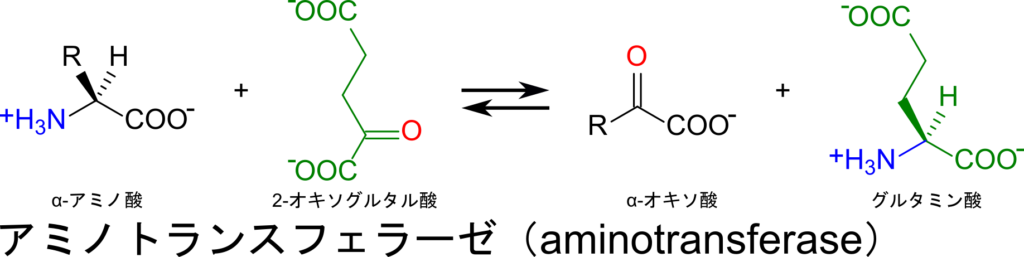
アミノ酸に含まれるアミノ基は、まずグルタミン酸に集められます。この反応は各種のアミノトランスフェラーゼによって触媒され、アミノ酸から 2-オキソグルタル酸にアミノ基が転移されます(図1)。なお、この反応はアミノ酸の生合成におけるアミノ基の転位反応の逆反応となっています。アミノトランスフェラーゼは、アミノ基転移反応を触媒する一群の酵素で、基質によって名称が異なります。例えば、アラニンを基質とする場合はアラニンアミノトランスフェラーゼ(alanine aminotransferase; ALT)、アスパラギン酸の場合はアスパラギン酸アミノトランスフェラーゼ(aspartate aminotransferase; AST)といった具合です。
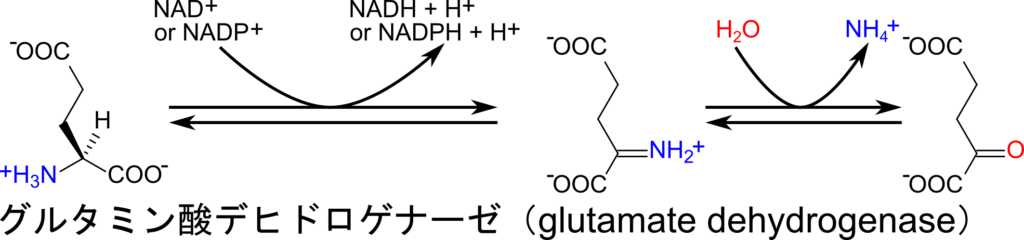
一度グルタミン酸に集められたアミノ基は、グルタミン酸デヒドロゲナーゼの作用によりグルタミン酸が酸化されると同時に、アンモニアとしてアミノ基が遊離されます(図1)。この反応はいったん脱プロトン化を受けてシッフ塩基※1が生成されます。このときに NAD+ あるいは NADP+ が補酵素として利用されます。その後、水が付加することで最終的にアンモニアが生成されます(図3)。なお、この反応もアミノ基の転位反応同様アミノ酸生合成におけるグルタミン酸生成の逆反応となっています。
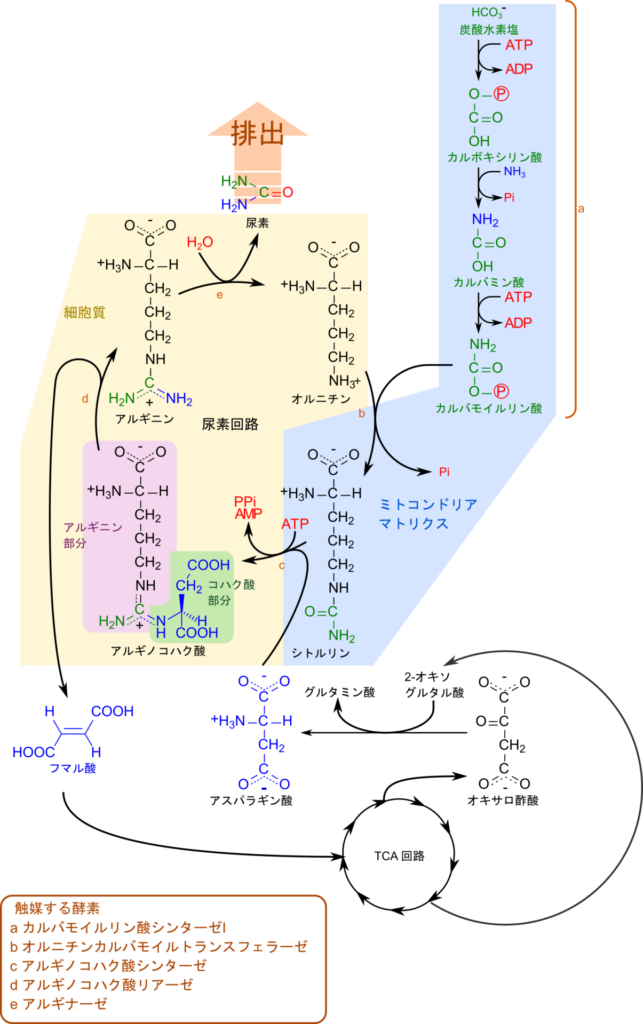
ところで、こうして遊離したアンモニアは生体にとって有害な物質ですので、無毒化する必要があります。そこで、この遊離したアンモニアと炭酸から ATP を消費してカルバモイルリン酸が生成されます。カルバモイルリン酸は尿素回路(Urea cycle)を経て尿素に変換されることで無毒化されて腎臓へ運ばれて排泄されます。このような尿素回路は陸生脊椎動物にみられ、尿素に変換して窒素を排泄する動物のことを尿素排出動物(ureotelic animal)と呼ばれます。
※1 シッフ塩基:カルボニル化合物(C=O)とアミン(-NH2)が結合して生成されるイミン(C=N)のことを言います。反応性が高く、容易にプロトンを受け取ったり水が付加したりする構造です。グルタミン酸デヒドロゲナーゼの反応の例ではアミノ酸から生成されるように見えますが、逆反応についてみるとケトンとアンモニアからイミンが生成されているので、この中間体はシッフ塩基ということができます。
アミノトランスフェラーゼの作用メカニズム
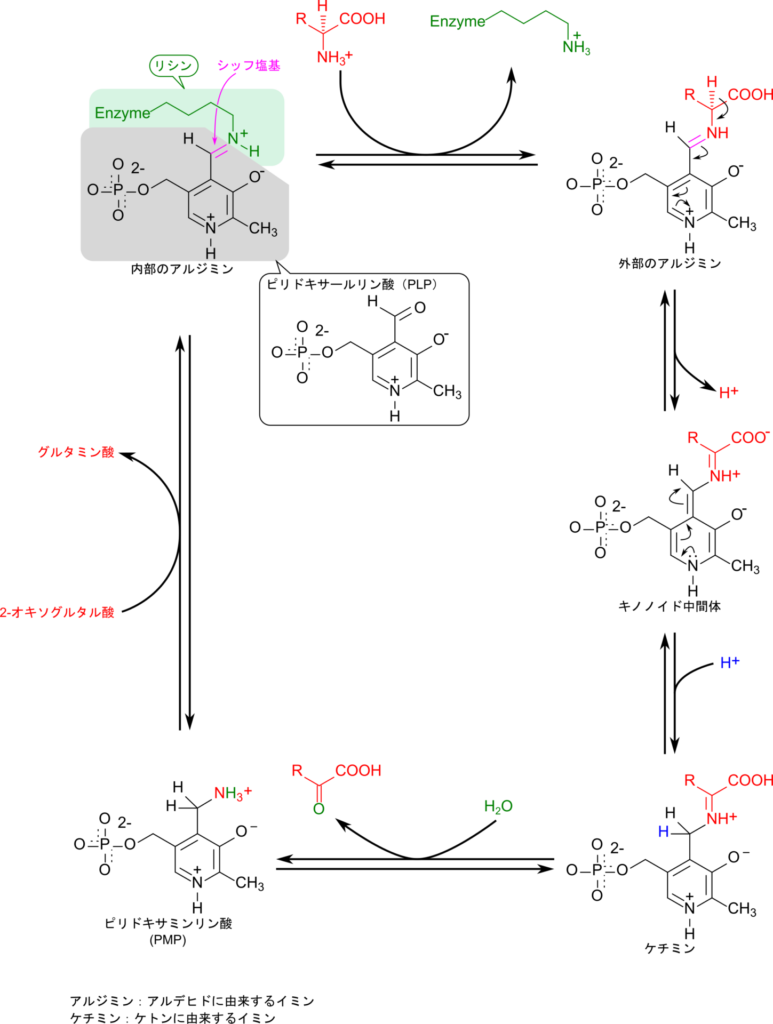
アミノ酸のアミノ基の転位反応は様々なアミノトランスフェラーゼによって媒介されます。この酵素はビタミン B6 の誘導体であるピリドキサールリン酸(Pyridoxal phosphate;PLP)を補酵素として保持しており、アミノ基転位反応に利用されます。なお、PLP は非共有結合やリシンとの共有結合を介して酵素と強固に結合しており、容易には遊離しないため補欠分子族とされています。
PLP はアミノ基転位反応で中心的な役割を果たします。PLP は最初、酵素中のリシン残基の側鎖アミノ基(ε-アミノ基)と結合しています。この結合はイミン(N=C)となっており、シッフ塩基が形成されています。基質アミノ酸が供給されるとアミノ基がイミンの炭素を攻撃して結合し、アミノ酸とリシン残基が入れ替わって新たなシッフ塩基を形成します。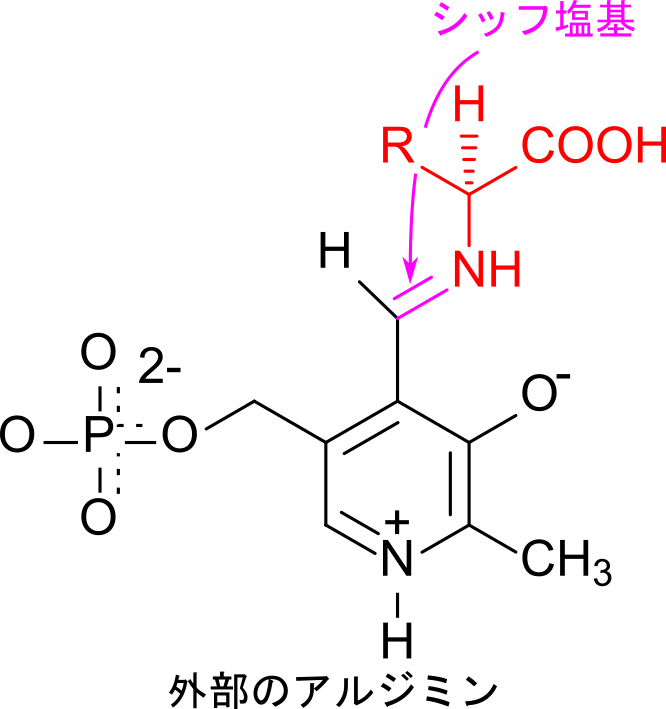
さらに、PLP は分子内部にピリジン環を有しています。このピリジン環の水酸基はプロトンを放出することで負電荷をもつフェノラートを形成します。一方で、窒素原子は非共有電子対を持っているのでプロトンが配位することでプロトン化されて正電荷を持つようになります。このことにより、PLP 分子の共鳴構造が安定化されます。フェノラート型の PLP では共鳴構造を利用してピリジン環が電子を引き込むことができるため、ホルミル基の求電子性が上昇し、アミノ基転位反応をスムーズに進行させることが可能となります(詳細は図4の外部アルジミン~ケチミンを参照してください)。
アミノ基転位反応で中心的な役割を担う置換基は PLP のホルミル基(-CHO)です。アミノトランスフェラーゼの中では、ホルミル基はリシン残基の側鎖アミノ基(ε-アミノ基)と結合してシッフ塩基を形成しています。この状態では酵素内部のリシンと結合しているので内部のアルジミン※2と呼ばれています。最初の反応では基質アミノ酸のアミノ基がシッフ塩基の炭素を攻撃して結合し、リシン残基と交換されて新たなシッフ塩基を形成します。このシッフ塩基も(反応している炭素原子はもともとホルミル基に由来するので)アルジミンですが、結合している相手が外部からもたらされたアミノ酸ですので外部のアルジミンと呼ばれて内部のアルジミンとは区別されています。
さて、基質アミノ酸と結合した外部のアルジミンは図4のようにキノノイド中間体を経てケチミンが生成されます。この過程では図4に示すようにピリジン環の窒素原子が電子を受け取ることで基質アミノ酸の α 炭素がうまく脱プロトン化されてイミンに変換されています。このように、PLP がフェノラート型をとることでこのような電子の遷移がスムーズに行われ、効率的な反応が実現されています。
生成されたケチミンは水の付加を受けてアミノ酸部分を遊離させますが、この際、アミノ基は PLP 側に保持され、残る部分が 2-オキソ酸として遊離します。ところで、この反応を逆に見てください。2-オキソ酸はケトンの構造を持つことがわかるかと思いますが、したがって、ケトン(2-オキソ酸)とアミン(ピリドキサミンリン酸;Pyridoxamine Phosphate, PMP)が結合してイミンを生成する反応とみることができます。このことからキノノイド中間体から生じた物質はケチミンと呼ばれています。
最後に、PLP に保持されたアミノ基が 2-オキソグルタル酸に転位されてグルタミン酸が生成されるとともに、酵素内のリシン残基の ε アミノ基が再度結合して元に戻ります。
※2 アルジミンとケチミン:シッフ塩基はカルボニル化合物とアミンが結合して生成されるイミンのことを言いますが、カルボニル化合物にはアルデヒドとケトンが想定されます。アルデヒドとアミンが結合してできたイミンのことをアルジミン(aldimine; aldehyde + imine)と呼び、ケトンとアミンが結合してできたイミンのことをケチミン(ketimine; ketone + imine)と呼びます。
尿素回路によるアンモニアの無毒化
尿素回路の反応経路
次に、尿素回路についてみていきましょう。
グルタミン酸から遊離したアンモニアはカルバモイルリン酸シンテターゼⅠ(Carbamoyl phosphate synthetase I;CPSⅠ)の作用により、炭酸水素塩や ATP 二分子を利用してカルバモイルリン酸を生成します。この反応はミトコンドリアで行われ、以下の三段階で進行します(図5)。
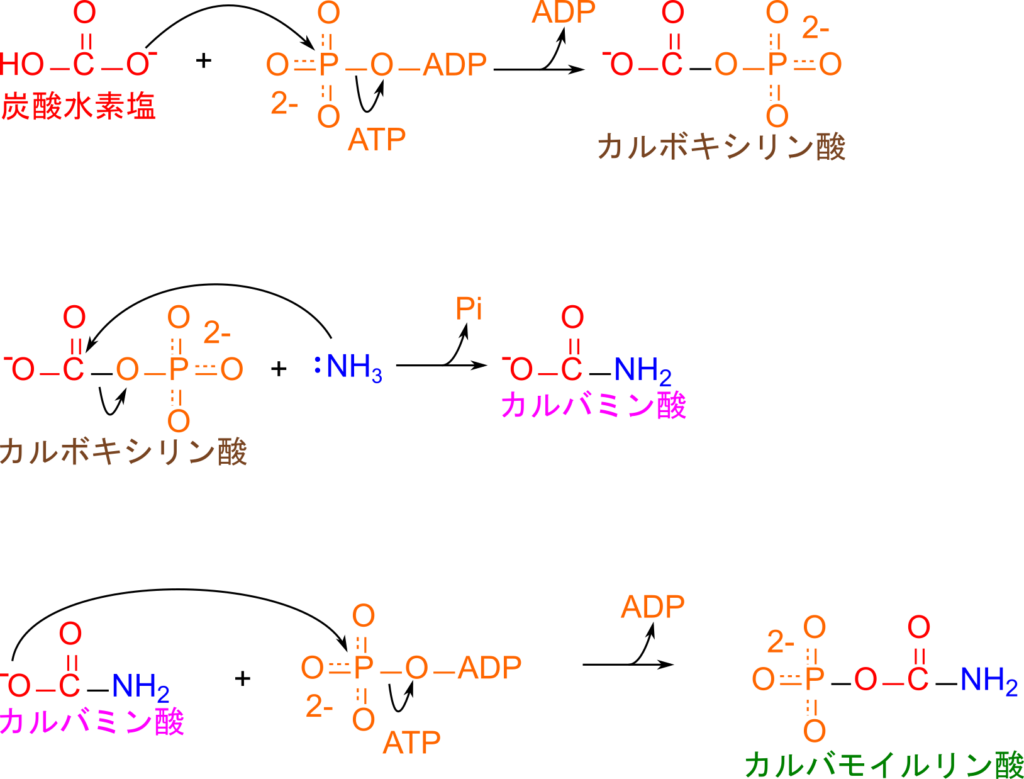
- 炭酸水素塩が ATP を消費してリン酸化されて活性化され、カルボキシリン酸と ADP が生成されます。
- カルボキシリン酸の炭素原子をアンモニアが求核的に攻撃してリン酸基と置き換わります。その結果、カルバミン酸と無機リン酸が生成されます。
- 最後にカルバミン酸がリン酸化を受けてカルバモイルリン酸が生成され、ADP が生成されます。
1 段階目及び 3 段階目に見られるリン酸化はそれぞれ炭酸水素塩あるいはカルバミン酸を活性化する作用があります。リン酸基は脱離しやすいため、リン酸化されることで次の反応を起こりやすくする作用があります。
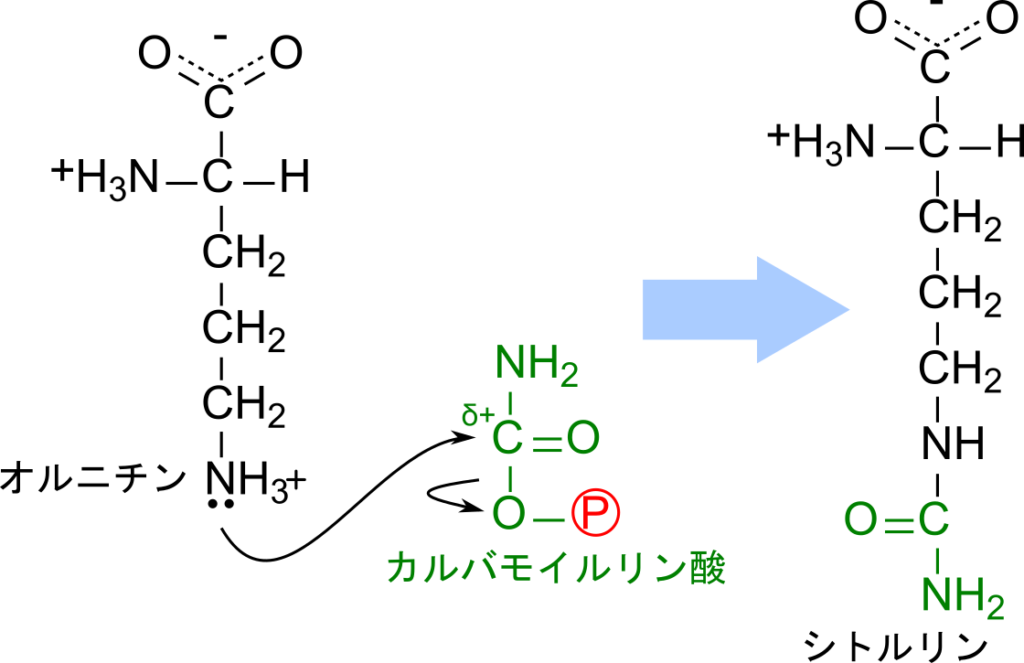
生成されたカルバモイルリン酸はオルニチンと会合してシトルリンを生成します。この反応はオルニチンの側鎖のアミノ基(δ アミノ基)がカルバモイルリン酸の炭素を攻撃して結合し、リン酸が脱離します。この反応もミトコンドリアで行われますが、これ以降の反応は細胞質で行われるため、産生されたシトルリンは細胞質に輸送されます。
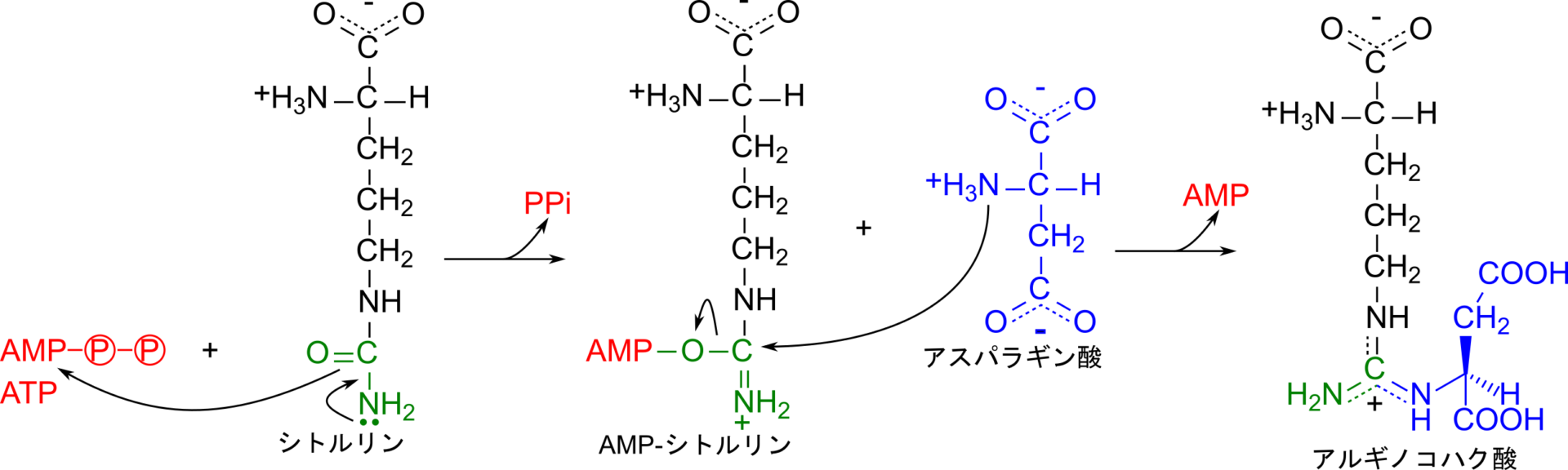
尿素回路は TCA 回路と関連して機能しています。TCA 回路で産生されたオキサロ酢酸はアミノ基転位を受けてアスパラギン酸に変換されます。一方で、シトルリンは ATP と反応して AMP-シトルリンが生成されて活性化されます。なお、この反応ではピロリン酸(PPi) が産生されますが、ピロリン酸は無機ピロホスファターゼの作用により無機リン酸にまで分解されます。このため、この反応では ATP 二分子に相当するエネルギーを消費しており、アルギノコハク酸の生成をより有利に進められることに貢献しています。続いてアスパラギン酸のアミノ基が AMP-シトルリンのウレイド基(NH2-CO-NH-)のカルボニル基を攻撃して結合を形成します。その結果、アルギノコハク酸が生成されます。この反応はアルギノコハク酸シンテターゼ(argininosuccinate synthetase)が触媒します。なお、アルギノコハク酸はシトルリンとアスパラギン酸が会合して得られますが、アルギニンとコハク酸が連結した構造とみなすこともでき、名称はこの視点からつけられています。
産生されたアルギノコハク酸はアルギノコハク酸リアーゼ(Argininosuccinate lyase)の作用により解離して、アルギニンとフマル酸に分解されます。産生されたフマル酸は TCA 回路に合流して再利用されます。最後にアルギニンはアルギナーゼの作用により尿素が遊離します。残った部分はオルニチンとなってミトコンドリアに輸送され、再びカルバモイルリン酸を受け取りサイクルが回っていきます。
尿素回路の調節機構
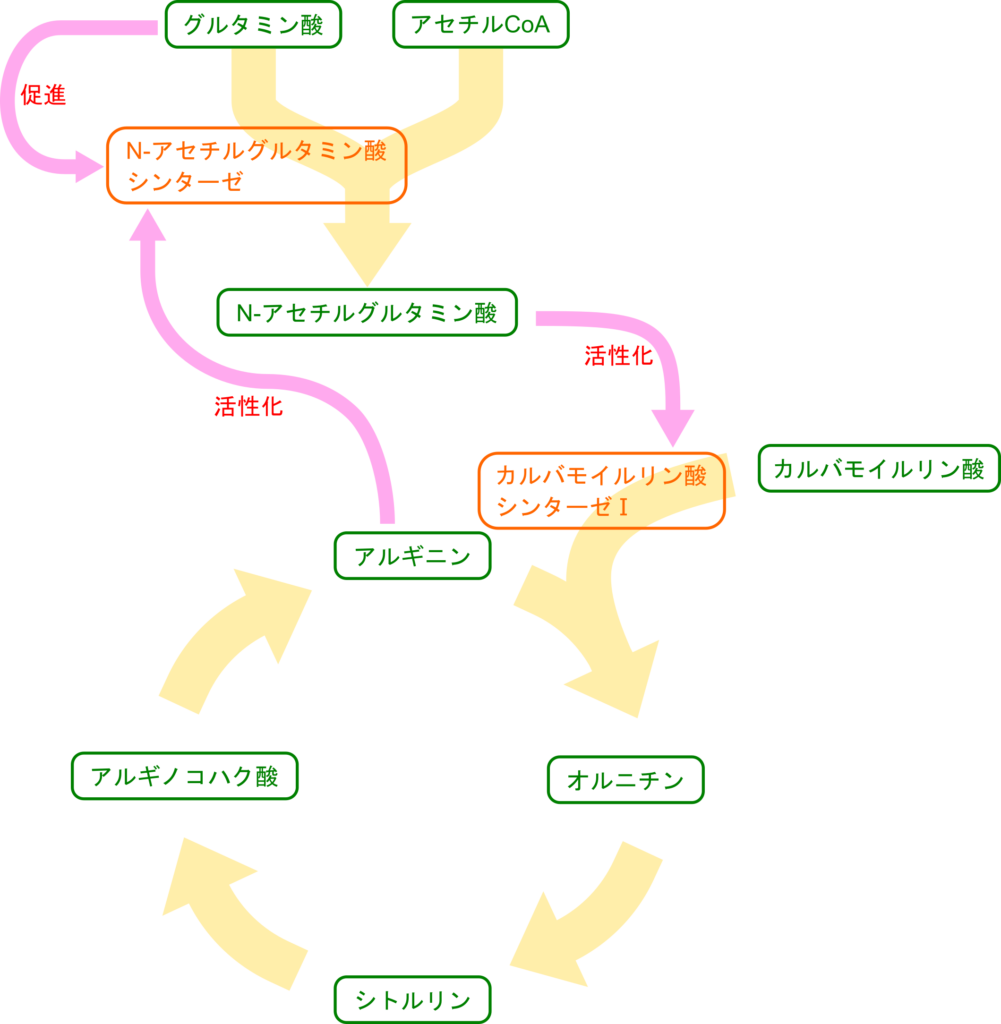
尿素回路は窒素原子の導入段階に当たるカルバモイルリン酸の生成段階で調整されています。この段階を触媒するカルバモイルリン酸シンターゼⅠは N-アセチルグルタミン酸(N–acetylglutamic acid; NAG)によってアロステリックに促進されます。促進されるというと N-アセチルグルタミン酸がなくとも活性を持つように思えますが、実際には N-アセチルグルタミン酸が不在の場合にはほとんど活性を発揮できません。N-アセチルグルタミン酸はグルタミン酸とアセチル CoA を使用して N-アセチルグルタミン酸シンターゼによって合成されます。さらに、N-アセチルグルタミン酸シンターゼはアルギニンによって活性化されます。また、グルタミン酸の存在もこの反応を促進します。まとめると以下のようになります。
- グルタミン酸、アルギニンのようなアミノ酸が豊富
- グルタミン酸やアルギニンにより N-アセチルグルタミン酸シンターゼの活性促進
- N-アセチルグルタミン酸(NAG)の合成上昇
- カルバモイルリン酸シンターゼⅠの活性が NAG によりアロステリックに促進
- 尿素合成の促進
このように、尿素回路の活性は肝臓で行われるわけですが、生体が置かれている状況に合わせて調整されています。
肝臓以外の組織で産生されるアンモニアの処理
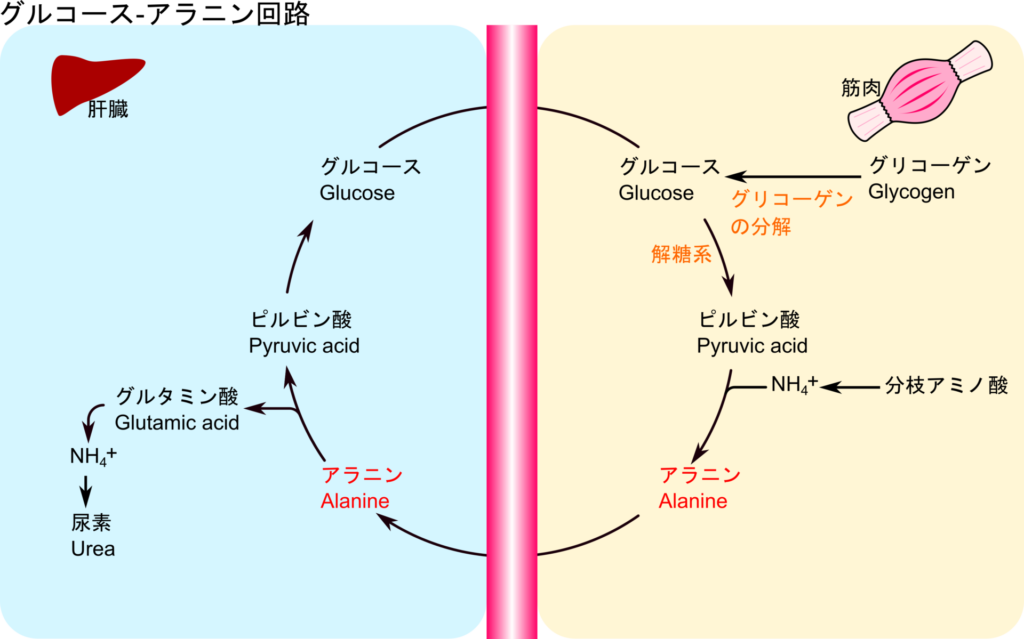
これまでは肝臓におけるアミノ基の代謝について議論してきました。ところで、飢餓状態に置かれ場合、筋肉のような末梢の組織においてもタンパク質とアミノ酸の分解が進み、エネルギーとして利用される場合があります。以前に説明した通り(詳しくはこちら)、アミノ酸は異化経路を介して炭素骨格が TCA 回路や解糖系で利用されます。一方で窒素原子は排泄されるわけですが、窒素排泄に必要な尿素生成は肝臓でしか行えません。そこで、末梢組織から肝臓に窒素原子を安全に運搬する必要があります。
アミノ酸から除去されたアンモニアは毒性が高く、そのまま運搬するには非常に危険です。そこで、遊離した窒素原子がアミノ基転位反応によってピルビン酸に転位されてアラニンに変換されることでこの問題を解決しています。生成されたアラニンは循環によって肝臓まで運搬されたのち、アミノ基を 2-オキソグルタル酸に転位してピルビン酸に戻り、グルタミン酸が生成されます。グルタミン酸に取り込まれたアミノ基はその後、アンモニアとして遊離したのち、尿素回路で尿素に変換されます。一方で、ピルビン酸は糖新生によってグルコース合成に利用されます(図7)。このグルコースは血流を介して再び筋肉に供給され、エネルギー源となります。このような窒素原子の輸送メカニズムをグルコース-アラニン回路(glucose-alanine cycle)と呼んでいます。
練習問題
参考文献
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.633-662, pp.597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.477-513
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 208-223
- KEGG PATHWAY DATABASE. 2025-03-03. https://www.genome.jp/kegg/pathway.html
- Ngo, H.-P.-T., Nguyen, D. Q., Park, H., Park, Y. S., Kwak, K., Kim, T., Lee, J. H., Cho, K. S., & Kang, L.-W. (2022). Conformational change of organic cofactor PLP is essential for catalysis in PLP-dependent enzymes. BMB Reports, 55(9), 439–446. https://doi.org/10.5483/BMBRep.2022.55.9.090
- Kneuttinger, A. C., & Sterner, R. (2021). The Structure of Carbamoylphosphate Synthetase Unravels Central Functional Features of a Key Metabolic Multienzyme Complex. Biochemistry, 60(46), 3422–3423. https://doi.org/10.1021/acs.biochem.1c00280
アミノ酸の異化は、エネルギーづくりと毒性アンモニアの処理という、体にとってとても大事な仕事を同時にこなしています。特にアミノ基の異化では中間産物にアンモニアという有毒な物質が産生されるわけですが、巧妙に無毒化して安全に排泄できるようにしてくれています。この記事を通して、そんな体内の複雑で面白い仕組みを少しでも身近に感じてもらえたら嬉しいです。ぜひもう一度読み返して、私たちの体がどれだけ巧妙にできているのか、楽しんでみてください!