アミノ酸はタンパク質の構成要素であるだけでなく、分解によって糖新生や脂質合成、ケトン体生成、エネルギー代謝に深く関与します。本記事ではアミノ酸の異化経路とその代謝産物の多機能性について、図解とともにわかりやすく解説します。さらに、ケトン体生成や糖新生などと合わせてアミノ酸の異化の生理的な位置づけについても考察します。
アミノ酸の分解経路の概要
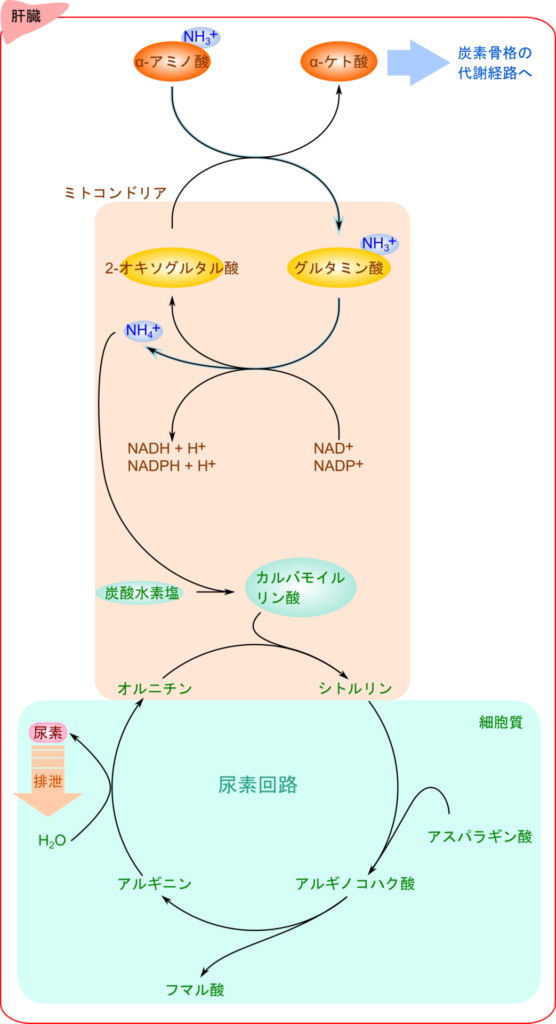
アミノ酸の分解においては、アミノ基と炭素骨格の経路を分けて理解すると、代謝の流れが明確になります。
まず、アミノ基の処理経路を見ていきましょう。アミノ基の処理は主に肝臓で行われます。アミノ酸が異化される際、多くはまずトランスアミナーゼ(transaminase)の作用により、そのアミノ基が 2-オキソグルタル酸に転移されることでグルタミン酸が生成されます。このように、各種アミノ酸から取り除かれたアミノ基は、一時的にグルタミン酸に集約されます。
続いて、生成されたグルタミン酸はミトコンドリア内に移行して、グルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase)によってアミノ基がアンモニア(NH₃)として遊離されて 2-オキソグルタル酸が生成されます。この過程はグルタミン酸が酸化されて脱アミノ化が達成されるため酸化的脱アミノ化(oxidative deamination)と呼ばれます。グルタミン酸デヒドロゲナーゼは、補酵素としてNAD+ とNADP+ の両方を利用できるという特徴的な酵素です。グルタミン酸はこの反応で 2-オキソグルタル酸に戻り、再びアミノ基を受け取る準備が整います。遊離したアンモニアは毒性が高いため、速やかに炭酸水素塩と反応してATPを消費し、カルバモイルリン酸に変換されます。カルバモイルリン酸に取り込まれた窒素原子は尿素回路を経て最終的に毒性の低い尿素として排泄されます。この過程は、ミトコンドリアと細胞質にわたって行われ、体内でのアンモニアの解毒において極めて重要です(図1)。
一方で、脱アミノ化された炭素骨格は、その種類に応じて解糖系やTCA回路の中間体となり、各代謝経路に組み込まれます。ある種のアミノ酸は、異化の結果としてアセチル CoA やアセトアセチル CoA を経てケトン体を生成します。一方でアセチル CoA は、脂肪酸合成の前駆体としても利用されます。また、アミノ酸由来の炭素骨格がオキサロ酢酸などの中間体を経由した場合には、糖新生へと流入し、最終的にグルコースやグリコーゲン合成に寄与することもあります。このように、アミノ酸の炭素骨格は解糖系・TCA回路・糖新生・脂肪酸合成といった多様な経路に再利用されます。なお、アミノ酸が分解されてオキサロ酢酸やピルビン酸、アセチル CoA などを生成する過程はアミノ酸の異化経路となりますが、脂肪酸合成や糖新生経路と合流すると(より高分子の化合物を生成する過程となるので)同化経路となるので注意してください。
アミノ酸炭素骨格の異化経路の概要
各アミノ酸は異化経路を経て解糖系や TCA サイクルの中間体に変換されます。これらアミノ酸の炭素骨格の代謝産物はアセトアセチル CoA、アセチル CoA、2-オキソグルタル酸、スクシニル CoA、フマル酸、オキサロ酢酸、ピルビン酸の7つに集約されます。このうちアセトアセチル CoA とアセチル CoA はケトン体の前駆体となるため、この二種類の代謝産物を与えるようなアミノ酸をケト原生アミノ酸(ketogenic amino acid)といいます。なお、これらの代謝産物は脂肪酸合成の前駆体にもなります。一方で、2-オキソグルタル酸、スクシニル CoA、フマル酸、オキサロ酢酸、ピルビン酸を代謝産物として生成するアミノ酸は糖原生アミノ酸(glucogenic amino acid)と呼ばれます(図2)。各アミノ酸がケト原生アミノ酸、糖原生アミノ酸のどちらかに分類されるというわけではない点に注意が必要です。もちろん、ケト原生のみを示すもの、糖原生のみを示すものもありますが、中にはケト原生と糖原生の両方を示すものがあります。以下の表に具体的な分類を示します。
| 分類 | アミノ酸名 | 生成される代謝産物 |
|---|---|---|
| 糖原生のみ | バリン | スクシニル CoA |
| アラニン | ピルビン酸 | |
| システイン | ||
| グリシン | ||
| セリン | ||
| トレオニン※ | ピルビン酸、スクシニル CoA | |
| アスパラギン | フマル酸、オキサロ酢酸 | |
| アスパラギン酸 | ||
| グルタミン | 2-オキソグルタル酸 | |
| グルタミン酸 | ||
| ヒスチジン | ||
| プロリン | ||
| アルギニン | ||
| メチオニン | スクシニル CoA | |
| ケト原生のみ | リシン | アセチル CoA、アセト酢酸、アセトアセチル CoA |
| ロイシン | ||
| 糖原生・ケト原生の両方 | フェニルアラニン | アセト酢酸、アセトアセチル CoA、アセチル CoA |
| チロシン | フマル酸 | |
| イソロイシン | アセチル CoA | |
| スクシニル CoA | ||
| トリプトファン | アセトアセチル CoA、アセチル CoA | |
| ピルビン酸 |
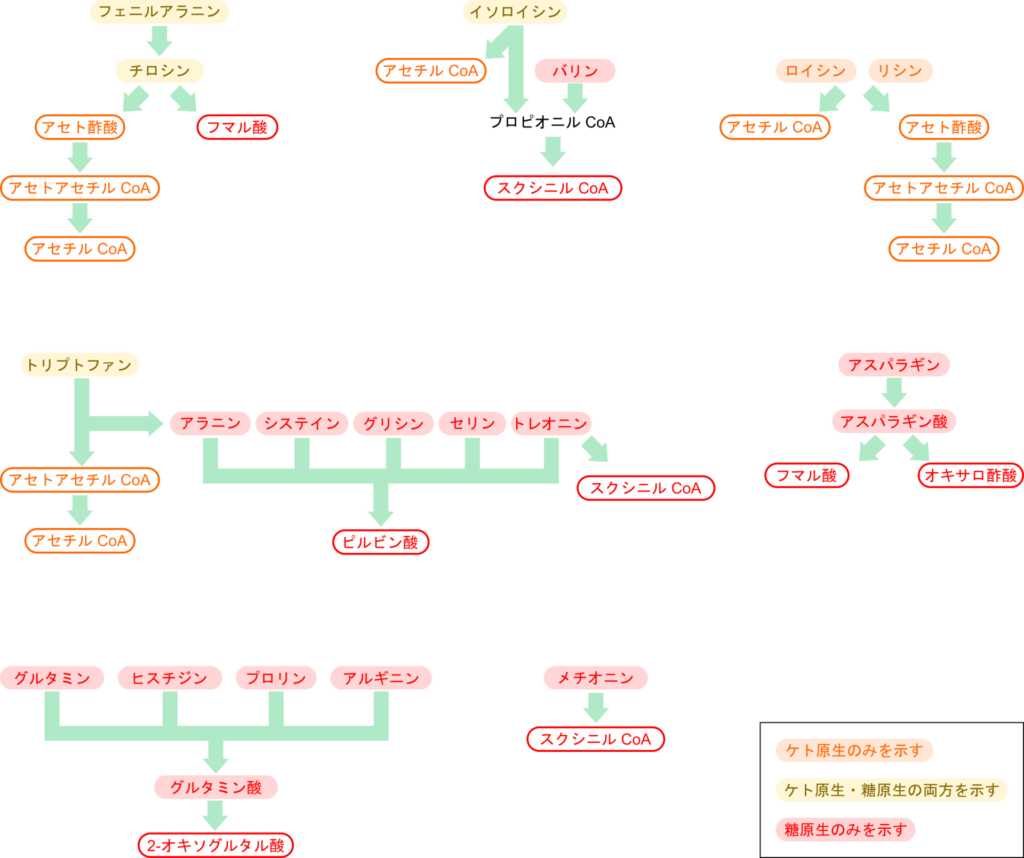
ところで、これらの異化経路とアミノ酸の生合成を見比べてみましょう(図2、図3)。異化経路はアミノ酸の生合成経路の逆反応であるわけではない点に気付くと思います。例えば、トレオニンは異化経路を経てピルビン酸を産生しますが、生合成経路ではオキサロ酢酸が原料となっています。また、イソロイシンはトレオニンから合成されますが、異化経路ではトレオニンとイソロイシンに関連性はありません。このように、生合成と異化では出発物質や中間体、酵素系がまったく異なるため、異化が単純に生合成の逆反応になるわけではないという点に注意が必要です。
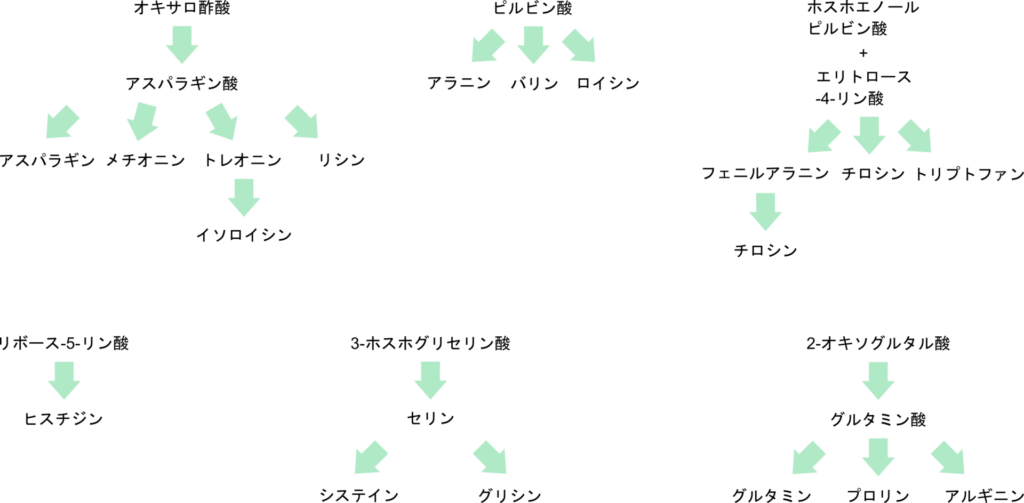
アミノ酸分解産物の行方
アミノ酸の異化産物の行方を見ていきましょう。
- ピルビン酸を供給するアミノ酸:
- アラニン、システイン、グリシン、セリン、トレオニン、トリプトファン
- 2-オキソグルタル酸を供給するアミノ酸:
- アルギニン、グルタミン酸、グルタミン、ヒスチジン、プロリン
- スクシニル CoA を供給するアミノ酸:
- イソロイシン、メチオニン、トレオニン、バリン
- フマル酸を供給するアミノ酸
- アスパラギン酸、フェニルアラニン、チロシン
- オキサロ酢酸を供給するアミノ酸:
- アスパラギン、アスパラギン酸
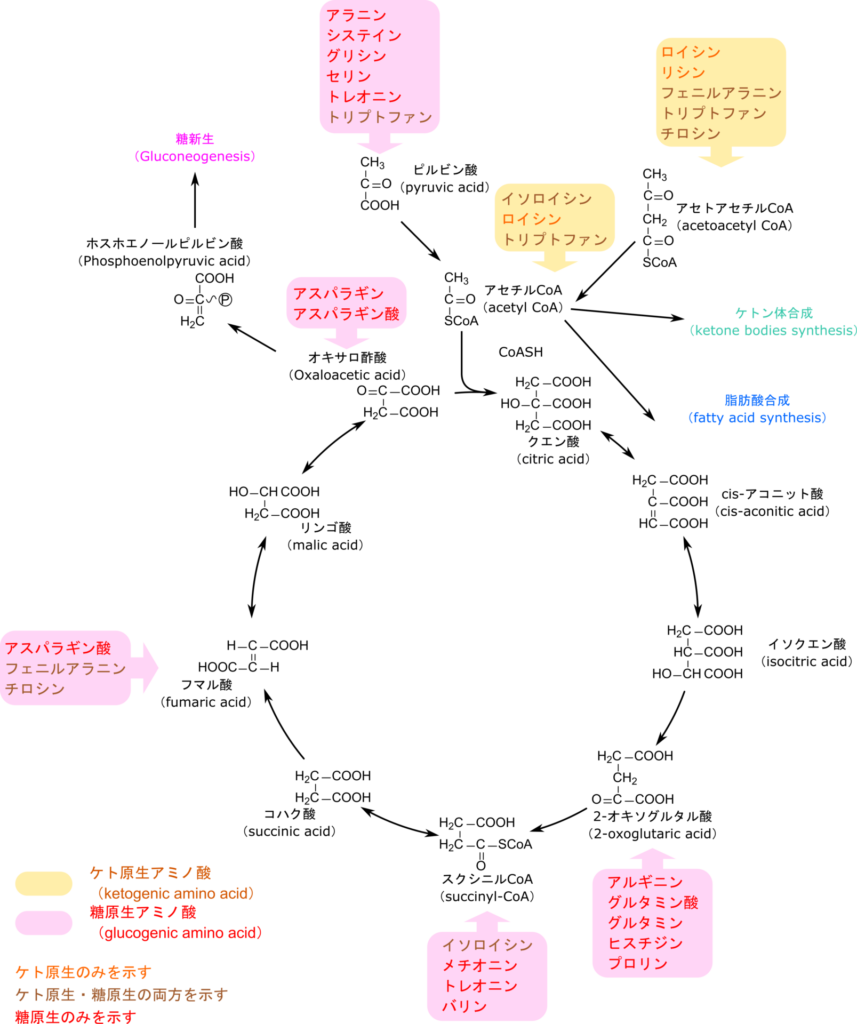
ピルビン酸は TCA 回路に炭素を供給する役割を担っています。一方で、2-オキソグルタル酸、スクシニル CoA、フマル酸、オキサロ酢酸は TCA 回路の中間体であり、エネルギー代謝に寄与します。特にオキサロ酢酸は糖新生の出発物質でもあり、グルコースやグリコーゲンの合成にも寄与します。
一方で、アセチル CoA を与えるアミノ酸はイソロイシン、ロイシン、トリプトファンであり、アセトアセチル CoA を与えるアミノ酸はロイシン、リシン、フェニルアラニン、トリプトファン、チロシンから供給されます。アセトアセチル CoA はアセチル CoA に分解されますが、アセチル CoA は TCA サイクルに合流するだけでなく、アセト酢酸のようなケトン体を生成したり、脂肪酸の生合成の出発物質でもあります。
このように、糖原生アミノ酸は糖新生の前駆体を、ケト原生アミノ酸は脂肪酸やケトン体の前駆体を提供します。いずれのアミノ酸も、TCA回路の中間体を通じてエネルギー代謝に貢献する点で共通しています。
ケトン体生成とエネルギー代謝
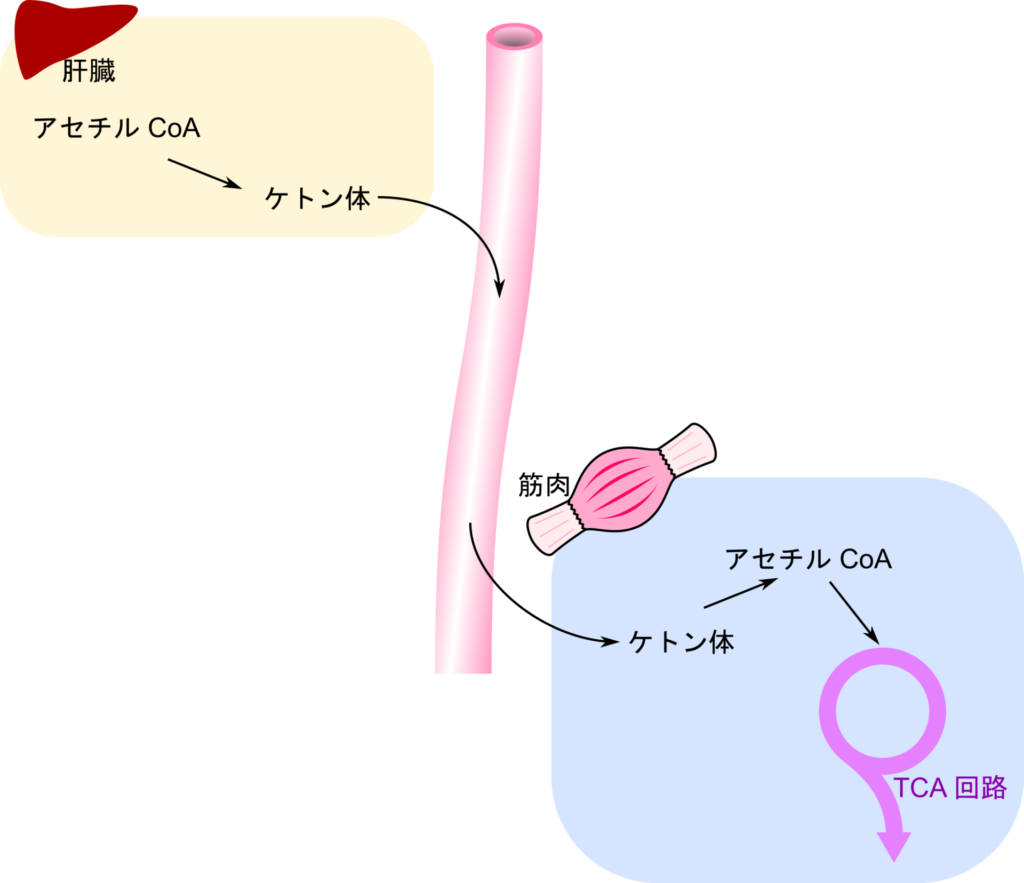
アセチルCoA はケトン体の原料となるためアセチル CoA を供給するアミノ酸をケト原生アミノ酸と呼びます。ところでケトン体とどういうものなのでしょうか?ここではケトン体について解説しようと思います。
糖が不足しているような環境下の肝臓では、脂肪酸が分解されてアセチル CoA が供給されることになります。その一方で、オキサロ酢酸は糖を生成するために使用されてしまうので、アセチル CoA を受け取る分子が不足してしまい、TCA サイクルでアセチル CoA を処理することができません。この余剰のアセチル CoA はアセト酢酸や 3-ヒドロキシ酪酸、アセトンに変換されます。これらのアセト酢酸や3-ヒドロキシ酪酸、アセトンはケトン体と呼ばれています。
ケトン体は通常、肝臓で産生され、血中を通じて心臓や腎臓などの組織に輸送されます。アセト酢酸や 3-ヒドロキシ酪酸はこれらの組織で通常でも利用されている燃料で、心臓などの組織ではグルコースよりもむしろアセト酢酸などのケトン体の方がよく使用されています。各組織ではケトン体がアセチル CoA に変換されて利用されます(図)。
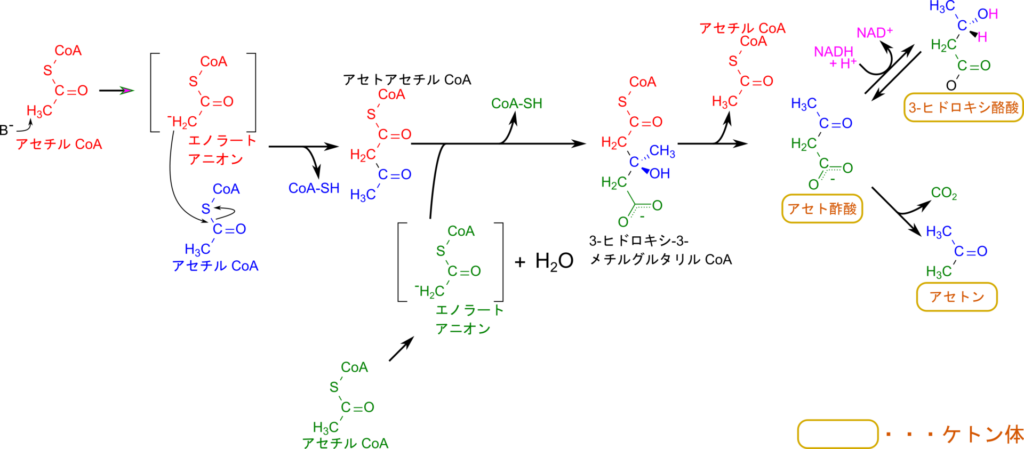
ケトン体の生成はアセチル CoA が会合してアセトアセチル CoA、さらに 3-ヒドロキシ-3-メチルグルタリル CoA が産生されてアセチル CoA が脱離してアセト酢酸が産生されます。アセト酢酸が還元される 3-ヒドロキシ酪酸が、アセト酢酸から炭酸が遊離するとアセトンとなります。アセトアセチル CoA や 3-ヒドロキシ-3-メチルグルタリル CoA の生成は本質的に同様の反応で、Claisen縮合と呼ばれます。この反応は有機化学でも重要な反応ですので詳しく見ていきましょう。まず、アセチル CoA のメチル基が脱プロトン化されることでエノラートアニオンが生成されます。エノラートアニオンとは以下のような構造を持つもので共鳴構造を持っています。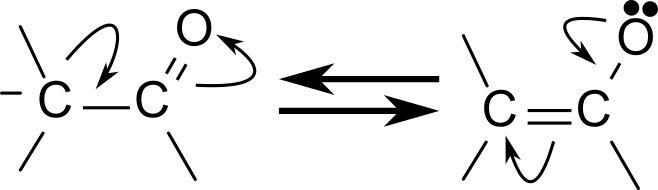
エノラートアニオンの α 炭素(-CH2–)が他のアセチル CoA のカルボニル基を求核的に攻撃して結合します。この時、アセチル CoA 側の CoA が遊離します。こうしてアセトアセチル CoA が生成されます。3-ヒドロキシ-3-メチルグルタリル CoA の生成も同様のメカニズムによって進行します。3-ヒドロキシ-3-メチルグルタリル CoA は酸化されると同時にアセチル CoA を脱離させてアセト酢酸が生成されます。アセト酢酸のカルボニル基が還元されると 3-ヒドロキシ酪酸が生成されます。なお、この反応は逆反応も起こり、ケトン体をアセチル CoA に変換する際に重要な反応になります。また、アセト酢酸が炭酸を脱離させるとアセトンが生成されます。これまでの過程は主に肝臓で行われ、生成されたケトン体は血中に放出されて各組織に供給されることになります。
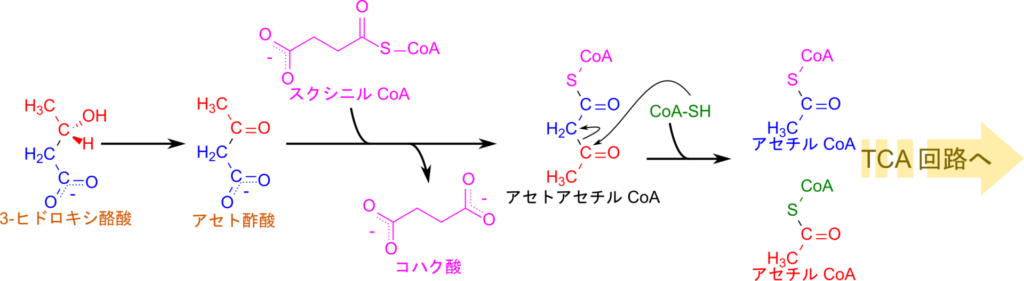
各組織に供給されたケトン体はアセチル CoA に変換されて利用されることになります。この過程を見ていきましょう。3-ヒドロキシ酪酸は酸化されるとアセト酢酸に変換されます。この過程はアセト酢酸を 3-ヒドロキシ酪酸に変換する逆反応ですね。アセト酢酸はスクシニル CoA から CoA を受け取ってアセトアセチル CoA に変換されます。アセトアセチル CoA は CoA を受け取ると解離して、アセチル CoA 二分子に分解されます。この反応は CoA のチオール基(-SH)がアセトアセチル CoA のカルボニル基を求核的に攻撃して結合するとともに、-CO-CH2– 間の結合が切断されて解離します。こうして産生されてアセチル CoA は TCA サイクルで利用されるようになります。
最後にケト原生と糖原生について考察していきます。ケト原生アミノ酸はアセチル CoA やアセトアセチル CoA を供給するアミノ酸でした。上述の通り、アセチル CoA や アセトアセチル CoA はケトン体の原料となりますが、ケトン体は各組織で TCA サイクルに利用されてエネルギー代謝に寄与することになります。一方で糖原生アミノ酸が供給する分子は 2-オキソグルタル酸、スクシニル CoA、フマル酸、オキサロ酢酸、ピルビン酸であり、これらの分子は TCA サイクルを通じてオキサロ酢酸を生成します。オキサロ酢酸は糖新生の原料となりますので、これらのアミノ酸の異化産物は糖(グルコース)の原料を与えるということになります。したがって糖原生と呼ばれるわけです。
練習問題
アミノ酸の異化においてアミノ基を受け取る役割を担う分子を選べ
アミノ酸からアミノ基を転位する反応にかかわる酵素は以下のうちどれ?
アミノ基の代謝について正しい文章を選べ
アミノ酸の異化によって生成される分子を選べ
アミノ酸をケト原生・糖原生・両方に分類してください。
ケト原生
糖原生
両方
今回は、アミノ酸の異化とその分解産物の行方について解説しました。アミノ酸は単なるタンパク質の構成要素ではなく、その分解産物はエネルギー代謝や糖・脂質の原料としても重要な役割を担っています。とくに飢餓状態においては、タンパク質の分解によってエネルギーが確保されるという代謝の仕組みが働きます。こうした視点から、アミノ酸の異化経路を理解することは、アミノ酸の多機能性を正しく把握するうえで非常に有益です。この記事では、異化経路のみならず、その代謝産物が持つ生物学的な意義についても意識して解説しました。繰り返し読み返しながら、アミノ酸代謝への理解を深めていただければ幸いです。なお、各異化経路の詳細については今後の記事で紹介していく予定です。
参考文献
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.633-662, pp.597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.477-513
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 208-223
- Edgar, A. J. (2002). The human L-threonine 3-dehydrogenase gene is an expressed pseudogene. BMC Genetics, 3(1), 18. https://doi.org/10.1186/1471-2156-3-18