糖は「ただ甘いだけの分子」ではありません。実は、わずかな条件の違いでまったく別の姿を見せる、きわめて反応性の高い分子です。たとえば、硫酸銅をアルカリ性下で作用させると赤褐色の沈殿が現れ、酸化条件を変えるだけでアルドン酸・アルダル酸といった異なる酸化生成物が得られます。さらに、メチル化剤を使えば複数ある水酸基を選択的にメチル化することもできます。

——なぜ糖は、これほど多様な反応を起こすのでしょうか? その背景には、環化・開環平衡や多数の水酸基、ホルミル基など、糖特有の構造と電子特性があります。
本記事では、①酸化・還元反応、②エーテル化/エステル化 、 ③縮合(グリコシド) 、 ④誘導体・反応の応用の順に整理し、その“面白さ”が伝わるよう反応機序とともに詳しく解説していきます。
Contents
還元糖を見分ける反応
グルコースに代表される糖には還元性(他の分子を還元する能力) を有するものがあります。この糖を還元糖といい、還元性に関連していくつかの反応が知られています。代表的な反応はフェーリング反応、Tollens 試験、臭素水による酸化反応です。後に解説しますが、フェーリング反応と Tollens 試験はアルカリ性下で行われ、アルドースもケトースも反応します。一方で、臭素水は弱い酸化剤であるためアルドースは反応するものの、ケトースは反応しません。この項目ではこれら代表的な反応を紹介します。
フェーリング反応では酸化銅の赤褐色沈殿を生じる
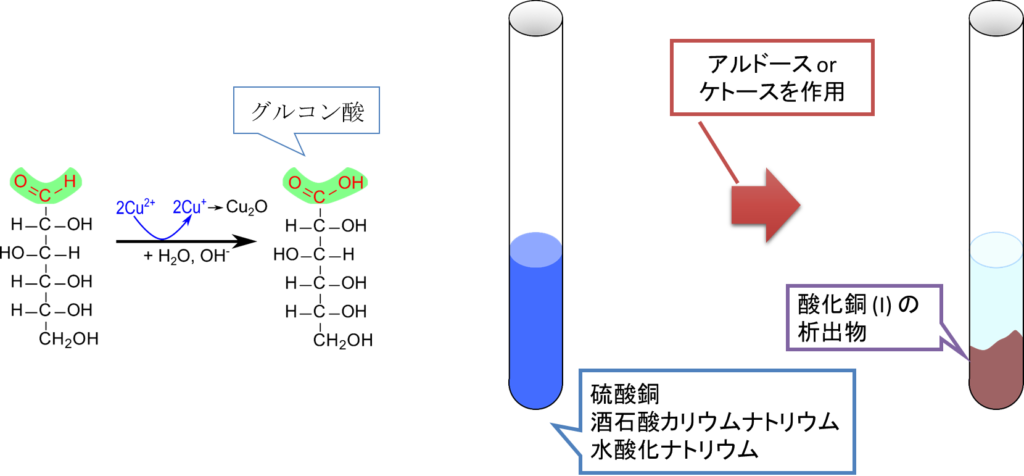
図1にフェーリング反応を記載しています。アルドースやケトースを硫酸銅とアルカリ性下で反応させると銅イオンが還元されて酸化銅(I)が生成されます。
R-CHO + 2Cu2+ + 5OH– → R-COO– + 3H2O + Cu2O
実際に反応させると、もともとは青い溶液の硫酸銅が赤褐色の沈殿を生じるとともに溶液の色が透明になっていきます。この反応をフェーリング反応といいます。この反応のポイントはアルカリ性下という点です。実はアルデヒドはアルカリ性下で還元性を発揮しやすくなります。この反応はこの性質をうまく利用しているわけです。なお、単糖は酸化されてアルドン酸に変換されます。
Tollens 試験では銀鏡を生成する
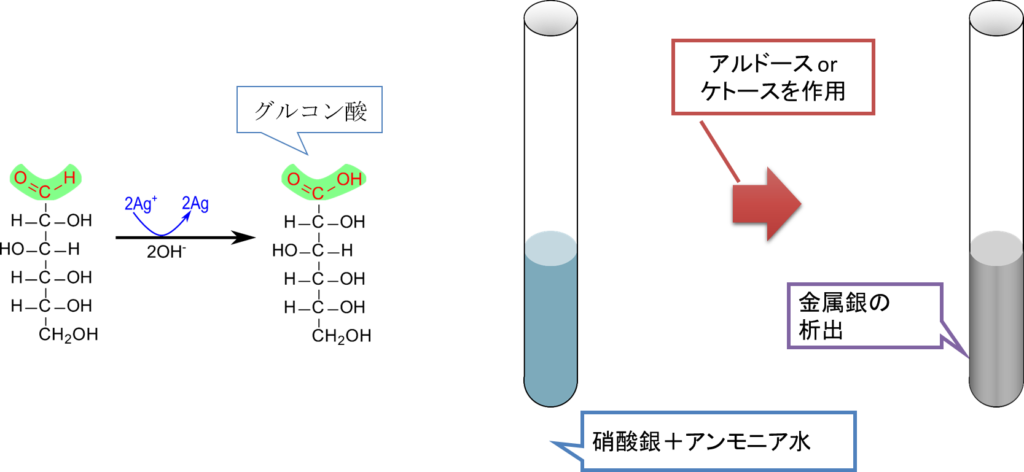
図2にTollens 試験を利用した反応を示しています。硝酸銀にアルドースやケトースをアルカリ性下で作用させると銀が還元されて金属銀が析出します。
R-CHO + 2[Ag(NH3)2]+ + 3OH– → R-COO– + 2Ag + 4NH3 + 2H2O
さて、この反応には少しコツがいります。銀をアルカリ性下に置くと酸化銀を生成して沈殿してしまいます。このような状況を避けるためにアンモニアを加えてあげます。すると、最初は酸化銀の沈殿を生じますがさらに添加すると錯体を形成して銀が溶けてくれます(実際にやってみると最初モヤっとした沈殿が生じたのち、さらに加えると沈殿が完全に消失して溶解します)。
第一段階:2Ag+ + 2OH- → Ag2O + H2O
第二段階:Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH–
これで反応させることができます。
この反応を実際にしてみると、試験管内部に金属銀が付着して鏡のようになります(銀鏡)。この反応をTollens 試験といいますが、銀鏡が生成することから銀鏡反応とも言います。なお、この場合も単糖は酸化されてアルドン酸に変換されます。
臭素水ではアルドースしか酸化できない
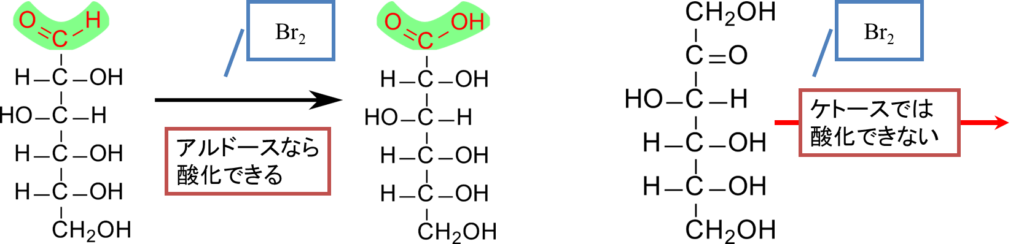
臭素水による酸化では、臭素が還元されて臭化物イオンへ変換されます。
R-CHO + H2O + Br2 → R-COO– + 2H+ + 2Br–
この反応では、アルドースだけが酸化されて、アルドン酸に変換されます。ケトースは酸化を受けません。この差はアルドース中のアルデヒド基の方が強い還元性を持つため、臭素水のように比較的弱い酸化剤を使用すると、ケトースは酸化できずにアルドースだけ酸化されるためです。
ケトースが還元性を示す不思議
ケト基は本来還元性を有しないため、普通なら臭素水のようにアルドースとのみ反応するほうが自然です。ところが、フェーリング反応と Tollens 試験ではアルドース・ケトースともに反応してしまいます。これはなぜでしょうか?
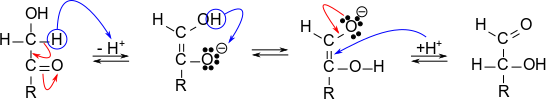
図4に示すようにケトースは塩基性下でエンジオールを介してアルドースと平衡状態を形成します。この反応をケト-エノール互変異性(keto–enol tautomerism)といいます。こうした反応様式は、生化学のさまざまな場面でも共通して重要になります。ここでしっかり理解しておくと、他の反応の理解にも役立ちます。では、機構を見ていきましょう。
ケト基に隣接する炭素に水素(α水素)が結合している場合、α水素がプロトンとして放出されます。その結果、エンジオール(enediol; CH(OH)=C(O–)-R)が生じます。 この構造はもう一つの構造(CH(O–)=C(OH)-R)と平衡を形成します。最後にπ電子にプロトンが供給されることで飽和化しアルドースが生成されます。アルドースは(アルデヒド基を持っていますので)還元性を持っていますから、結果ケトースは還元性を示すことになります。フェーリング反応やTollens 試験ではアルカリ性下で反応させますよね。ですので、反応させる対象がケトースであってもアルドースが生成されるため還元性を有するのです。
酸化反応による糖鎖の分析
さて、これまでの反応を図5にまとめてみました。アルドースやケトースは還元性を示すため還元糖と呼ばれます。フェーリング反応やTollens 試験は還元糖を見分ける際に使用できます(一部のオリゴ糖や多糖などの中には還元性を示さないものもあります)。さらに臭素水で酸化させてみると、アルドースは酸化されますが、ケトースでは酸化されません。このように、単糖の同定にこれらの反応が利用されることがあります。
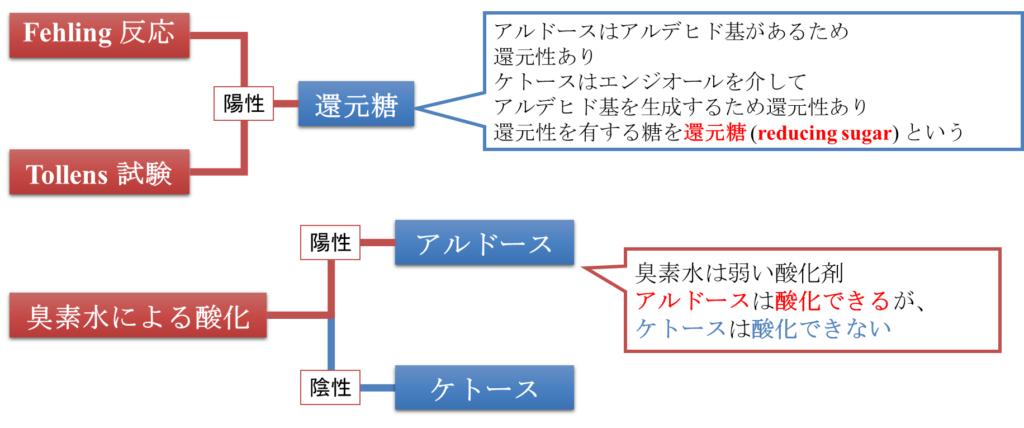
単糖の酸化物(アルドン酸、アルダル酸、ウロン酸)と還元物(糖アルコール)
アルドースの酸化は反応様式により様々な酸を生成する
図6に単糖の酸化についてまとめてみました。臭素水などによる弱い酸化を行うとアルデヒド基のみが酸化されます。この酸をアルドン酸(Aldonic acid)といいます。アルドン酸は元の単糖の語尾を~オン酸(~ onic acid)に変えて命名します。例えばグルコースから誘導される場合はグルコン酸(Gluconic acid)、ガラクトースから誘導されるならガラクトン酸(Galactonic acid)といった具合です。
次に、強い酸化剤を用いて酸化した場合はアルデヒド基だけでなく、末端の水酸基(アルデヒド基と反対側の水酸基)も酸化されてアルダル酸(Aldaric acid)が生成されます。アルダル酸は元の単糖の語尾を~アル酸(~aric acid)に変えて命名します。例えばグルコースから誘導される場合はグルカル酸(Glucaric acid)、ガラクトースから誘導されるならガラクタル酸(Galactaric acid)といった具合です。
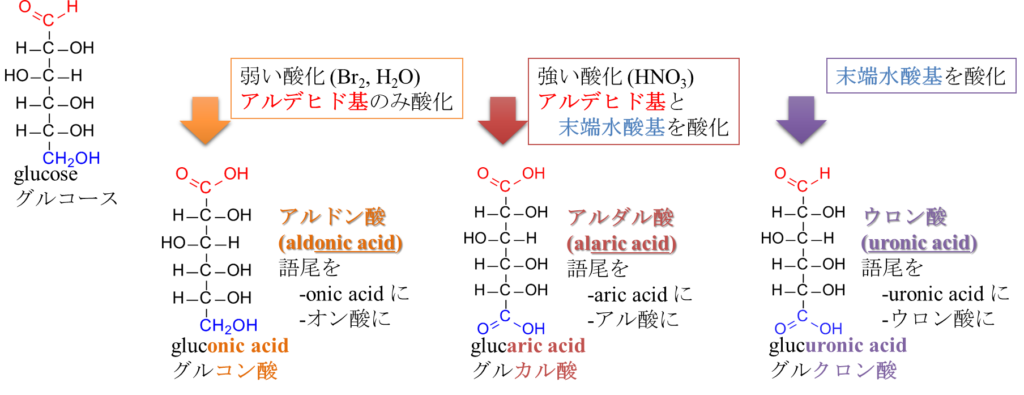
最後に紹介するのはウロン酸(Uronic acid)です。これは末端の水酸基だけがカルボキシル基に変換された化合物です。命名法は元の単糖の語尾を~ウロン酸(~uronic acid)に変えて命名されます。例えばグルコースから誘導される場合はグルクロン酸(Glucuronic acid)、ガラクトースから誘導されるならガラクツロン酸(Galacturonic acid)といった具合です。さて、これら3種類の酸の内ウロン酸だけは還元性を持っています。これは、アルデヒド基が残っているためです。また、分子内ヘミアセタールも生成されます(図7)。
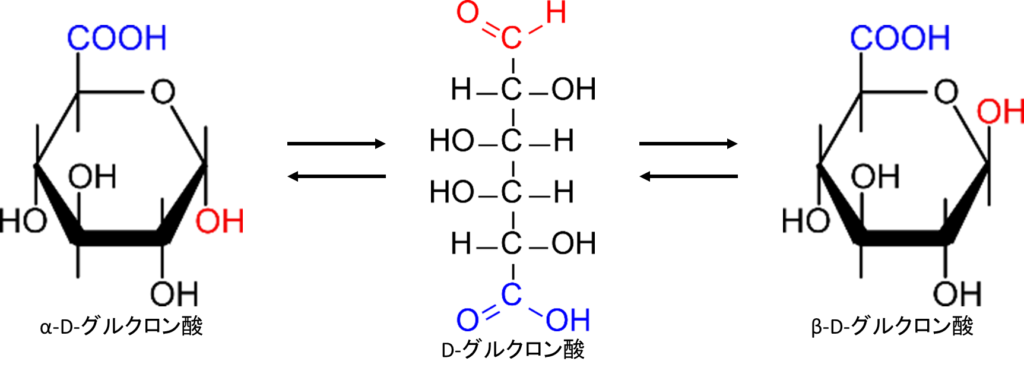
単糖を還元すると糖アルコールが生成される
図8に示すように単糖を水素化ホウ素ナトリウム (NaBH4) などで還元するとアルデヒド基やケト基が還元されて糖アルコール(sugar alcohol)に変換されます。こうして生成された糖アルコールは語尾を~イトール(~ itol)に変えて命名します。図8の例ではグルコースの語尾をイトールに変えてグルシトール(Glucitol)となります。
糖アルコールについては注意が必要です。図8を見てください。D-グルコースを還元するとホルミル基が還元されて水酸基となり、D-グルシトールが生成されます。一方でD-フルクトース(右)を還元すると、2位のケト基が還元されて水酸基となり、やはりD-グルシトールが生成されます。異なる糖を還元しても生成物が全く一緒になる場合があるので注意が必要となります。
糖から誘導される化合物
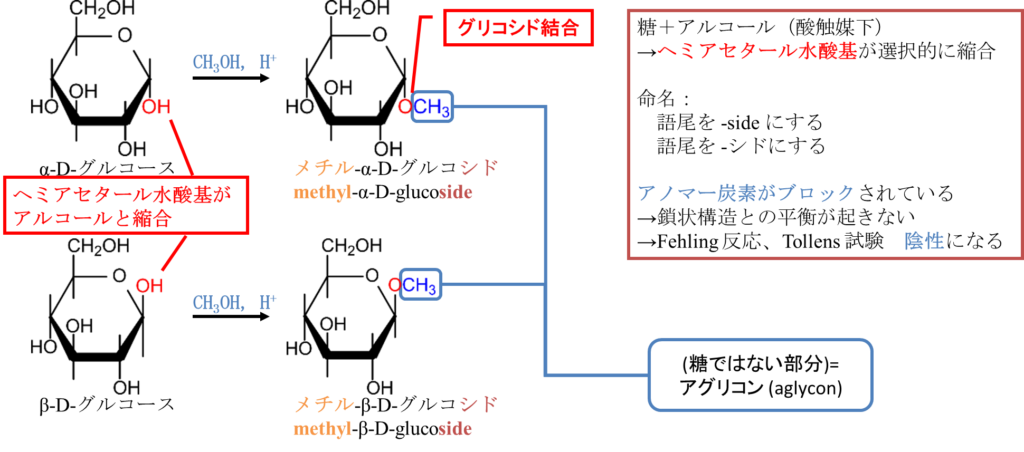
糖とアルコールを縮合するとグリコシドが生成される
酸性化で糖とアルコールを反応させると図9のように糖とアルコールの縮合体が生成されます。この時、ヘミアセタール水酸基が最も反応性が高いため優先的に縮合します(グリコシド;Glycoside)。なお、糖に由来しない部分(今回はメチル基ですね)のことをアグリコン(Aglycone)といいます。このような化合物は縮合した炭素鎖に続けて糖の名前を並べます。ただし、糖の名前の語尾はグリコシドであることを表すため~シド(~side)にします。例えば、図7の例では縮合した炭素鎖は炭素1個ですのでメチル基です。これにα(または β)D-グルコースを続けますが、グルコース(Glucose)の語尾を~シド(~side)に変えて、グルコシド(Glucoside)にします。したがってメチル-α (又は β) -D-グルコシド(Methyl-α (or β) -D-Glucoside)とします。
グリコシドはヘミアセタール水酸基がブロックされてしまいます。そのため開環して鎖状構造をとることができません。ということはアルデヒド基が生成されなくなるため還元性が発揮されなくなります。フェーリング反応や Tollens 試験が陰性になります。
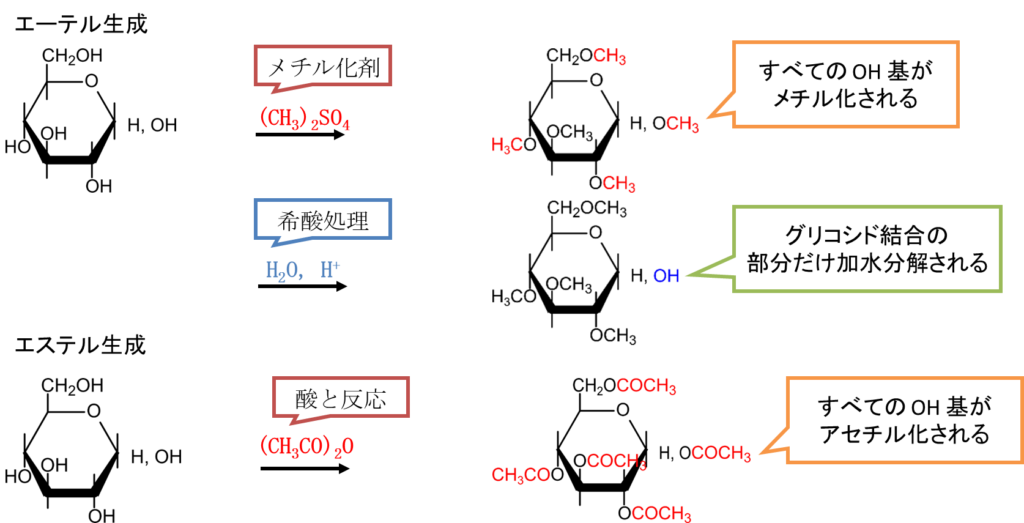
糖のエーテル化、エステル化
糖をメチル化剤で処理すると、すべての水酸基がメチル化されます。こののち、酸で処理するとヘミアセタール水酸基だけが加水分解されます。すると、グリコシドと真逆の構造を持つ化合物が生成されます。一方で酸と反応させると、すべての水酸基がエステル化されます。このように、単糖もエーテル化、エステル化することが可能です(図10)。
糖誘導体を応用した技術
さて、これまでいろいろな反応を見てきましたが、実際にどのような応用があるのでしょうか?いくつか紹介してみようと思います。
ウロン酸の合成
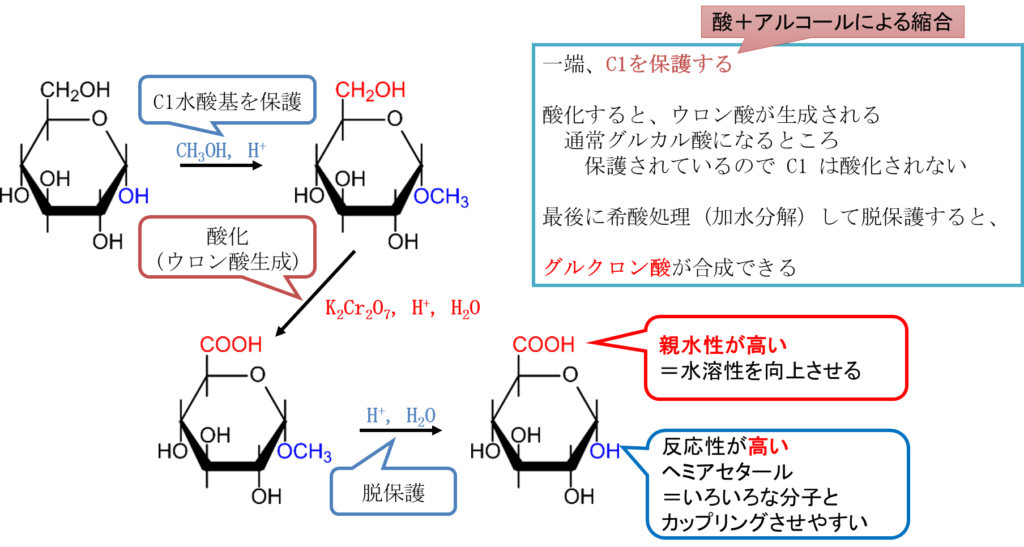
ウロン酸を生成する場合、普通に酸化するとホルミル基の方が水酸基より高い反応性を持つのでアルドン酸が優先的に産生されるはずです。ではどうやってウロン酸を生成するのでしょうか?
その答えを図11に示しています。この手順では、グルコースをグリコシドに変換します。このステップが一連の反応のポイントです。こうすることで開環しなくなるのでホルミル基がマスクされて(隠されて)しまいます。この状態で酸化してあげるとアルデヒド基の酸化は起こらず、6位の水酸基だけが酸化されます。最後に酸で処理してあげると、ヘミアセタール水酸基は加水分解することができますので、加水分解されてグルクロン酸が生成できます。このように反応してほしくない置換基をマスクする手法は有機合成でよく使われる手法です。
グルクロン酸の利用
生成されたグルクロン酸はどのように利用されるのでしょうか?実はグルクロン酸は優れた特性を二つ持っています。
一つ目はグルクロン酸にはカルボキシル基や水酸基など親水性の高い置換基がたくさんついているため、親水性がとても高い物質である点です。このような物質は疎水性の物質と結合させることで相手の化合物の親水性を上げることができます。例えば薬効が高い物質があっても疎水性が高いと投薬しにくくなります。そこでグルクロン酸を結合させることで親水性を高め、投薬効率を上げることができます。
そうなるとグルクロン酸が結合させやすくないと具合が悪いですね。そこで重要になるのが二つ目の特性であるヘミアセタール水酸基の反応性の高さで、この構造があるためグルクロン酸は縮合させやすい構造を持っています。このような優れた特性のためグルクロン酸は応用性の高い物質です。
そのほかの特殊な糖について
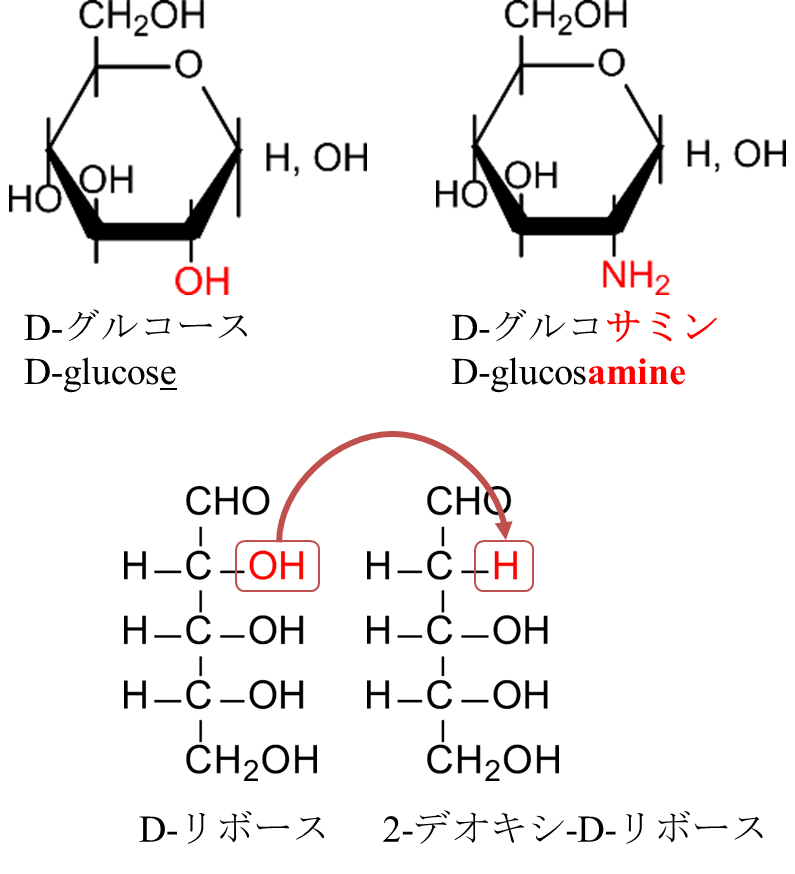
以下は特殊な糖について簡単に説明します。
水酸基のいずれかがアミノ基で置換されている糖をアミノ糖(Amino sugar)といいます。命名法は語尾を~アミン(~amine)にします。代表的な例はグルコースから誘導されるグルコサミン(Glucosamine)でしょう。
水酸基 (-OH) が水素 (-H) で置換されている糖をデオキシ糖(Deoxy sugar)といいます。脱(デ)酸素原子(オキシ)と覚えれば覚えやすいと思います。代表例はリボースのデオキシ糖であるデオキシリボースでしょう(図12)。
練習問題
問1.フェーリング反応について正しい記述を選べ
問2.Tollens 試験について正しい記述を選べ
問3.以下の反応は還元糖の酸化反応である。この中でケトースを酸化できない反応を選べ
ケトースが還元性を示す理由で正しいものを選べ
次の分子をアルドン酸・アルダル酸・ウロン酸・糖アルコールに分類せよ
分子タイルをクリックして選択し,下の分類枠(グレーの欄)または「分子タイル」の枠をクリックして移動させてください。
グルコースからグルクロン酸を化学的に合成する手順を、正しい順に並べなさい。
今回は、単糖が示す多様な反応性について、外観だけでなく反応機構まで踏み込んで解説しました。単糖はホルミル基をはじめとする反応性の高い官能基を持ち、さらに多数の水酸基をそなえているため、酸化・還元・エステル化・エーテル化・縮合など、きわめて幅広い反応を示します。とくに、ヘミアセタール性の水酸基の反応性の高さは糖化学を理解するうえで欠かせない特徴です。
また、ケト-エノール互変異性、保護基の導入と脱保護、グリコシド形成といった機構的理解は、単糖の反応に限らず、生化学・代謝・糖鎖生物学など幅広い生命科学分野で応用できる基礎となります。構造がどのような反応性につながるかを考える習慣は、より複雑な反応を読み解くうえでも役立つはずです。
単糖の反応は一見複雑ですが、反応性を決める構造的・電子的特徴に注目すれば、体系的に整理して理解できるようになります。ぜひ本記事を参照しながら反応の流れを追い、糖化学の「考え方」を自分の中に構築してみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 5-34
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 290-313
- John McMurry著、伊東椒、児玉三明訳 (2000). マクマリー有機化学 第4版. 東京化学同人. pp. 439-470
- K. P. C. Vollhardt, N. E. Schore著、古賀憲司、野依良治、村橋俊一、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人訳 (2020). ボルハルト・ショアー現代有機化学 第8版. 化学同人. pp. 1425-1486
- Chen, J., Yu, Y., Gao, J., & Yang, S. (2019). UDP-glucose Dehydrogenase: The First-step Oxidation Is an NAD + -dependent Bimolecular Nucleophilic Substitution Reaction (S N 2). International Journal of Biological Sciences, 15(2), 341–350. https://doi.org/10.7150/ijbs.28904
関連記事
糖鎖の基本について
糖鎖の化学反応について
オリゴ糖・多糖について
解糖系について
- 解糖系(glycolysis)によって糖からエネルギーを取り出しATP を生成する
- 解糖系の各反応をエネルギー的観点から読み解く
- 解糖系で利用される糖はグルコースに限らない
- 解糖系の制御は三つの律速酵素に対する調節で行われる
TCA サイクルについて