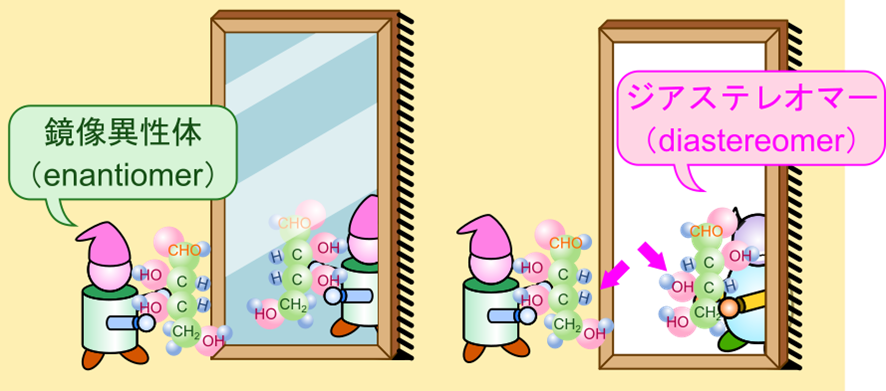
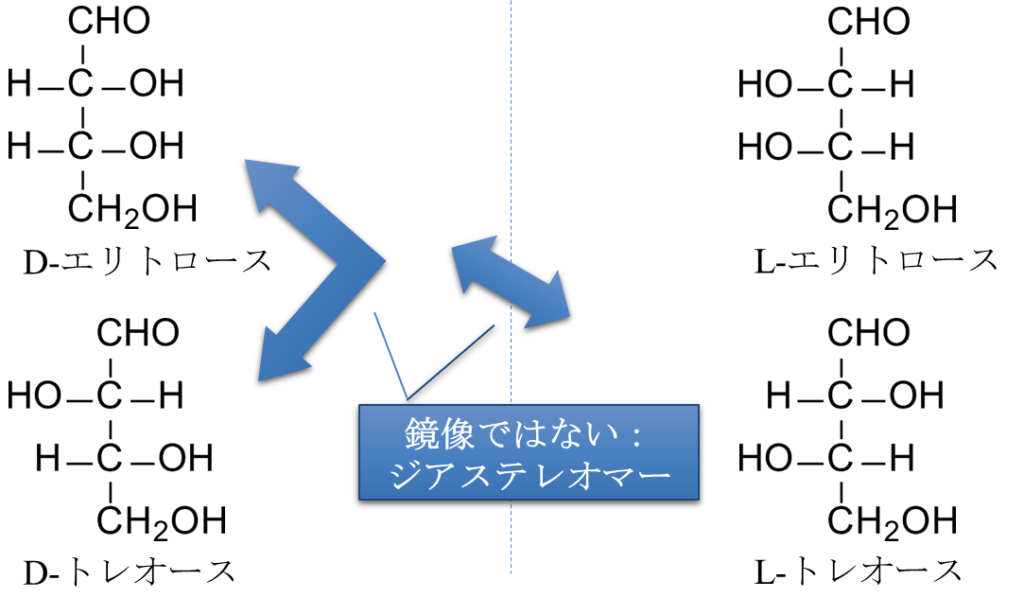
糖鎖をはじめ、有機化合物には立体異性体をもつものが数多く存在します。立体異性体のうち、左図のように全体が鏡写しの関係になっているものを鏡像異性体(enantiomer)といい、鏡写しにはならず、一部の立体配置だけが異なっているものをジアステレオマー(diastereomer)と呼びます(赤矢印の部分が鏡像関係ではありません)。
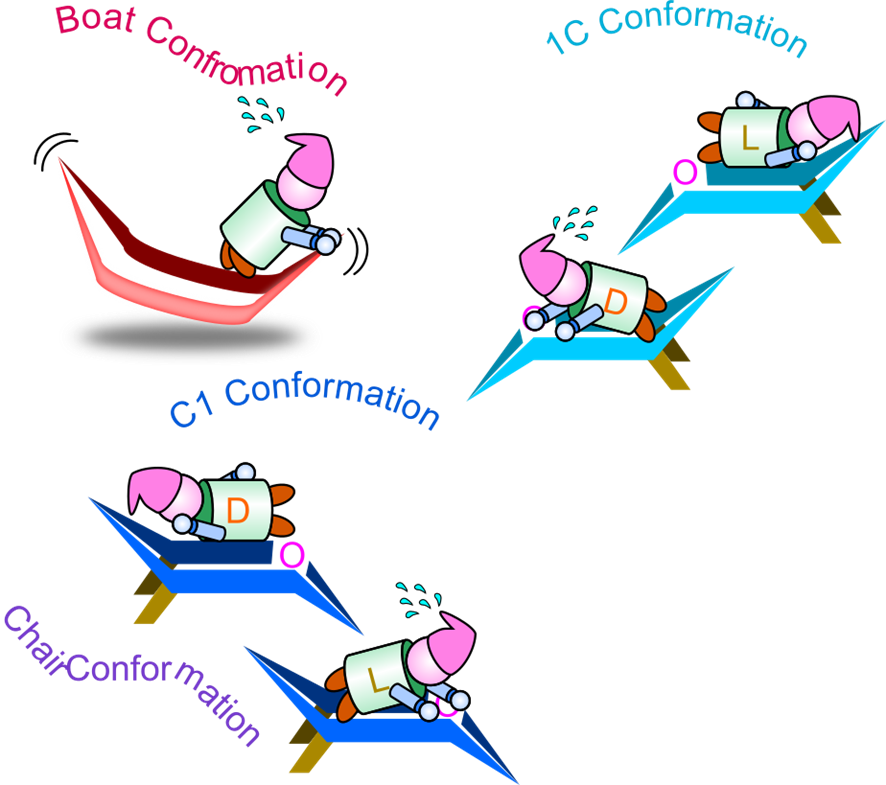
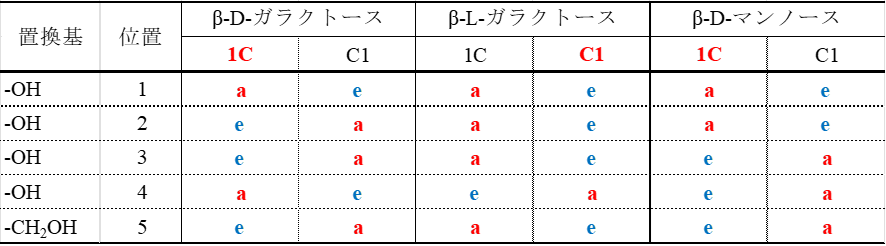
六員環を持つ単糖の構造は舟形といす形が想定できますが、舟形の方が不安定な構造となり、一般にいす形の構造がとられます。いす形の配座には C1 配座と1C 配座が存在しますが、一般にD体は C1 配座をとりやすく、L体は 1C 配座をとりやすいという特徴があります。
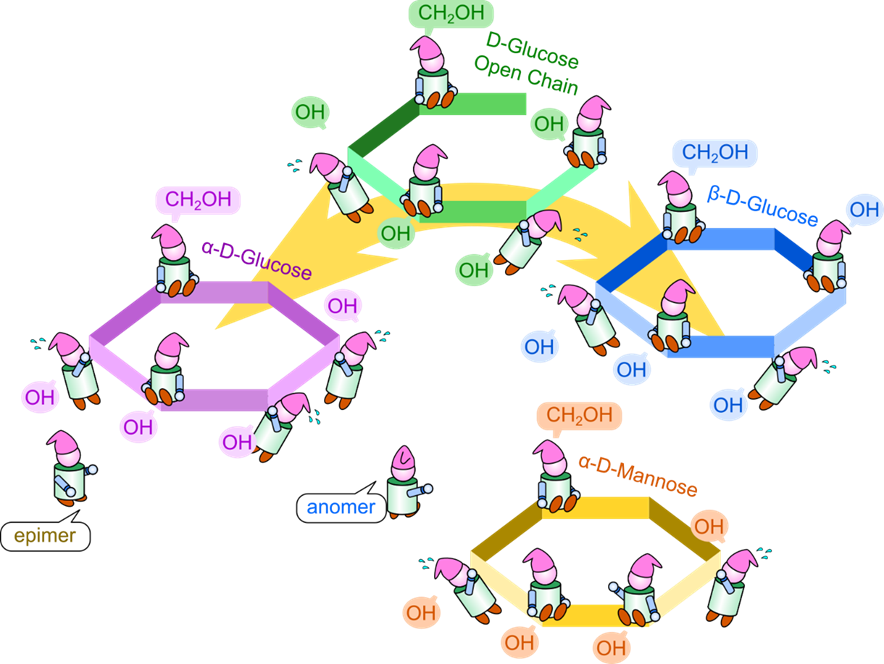
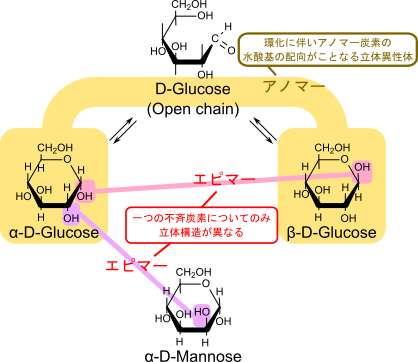
また、複数の不斉炭素があるにもかかわらず、一つの不斉炭素についてのみ立体構造が異なる関係にあるものをエピマーといいます。一方で環化に伴って発生する立体異性体、α 体と β 体のような関係にある異性体をアノマーと呼びます。
今回の記事では一見複雑な単糖の立体化学を基礎から解説します。
Contents
不斉炭素原子と立体異性体
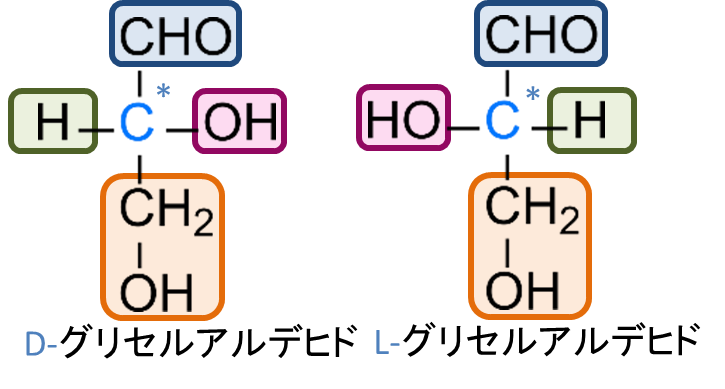
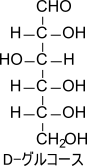
図1にD-グリセルアルデヒドの構造を示しています。2 位の炭素に注目すると、4 本の結合手がそれぞれ異なる置換基(ホルミル基、水素、ヒドロキシメチル基(–CH₂OH)、水酸基)をもっています。このような炭素原子を不斉炭素原子といい、慣例的に右肩に “*” を付けて表します。
図1の右側と左側を見比べてみてください。この二つの構造はどう回転させてもぴったり重ね合わせることはできません。このような関係にある化合物は立体的に異なる異性体の関係となっていることから立体異性体と呼ばれます。
鏡像異性体:鏡写しの立体異性体
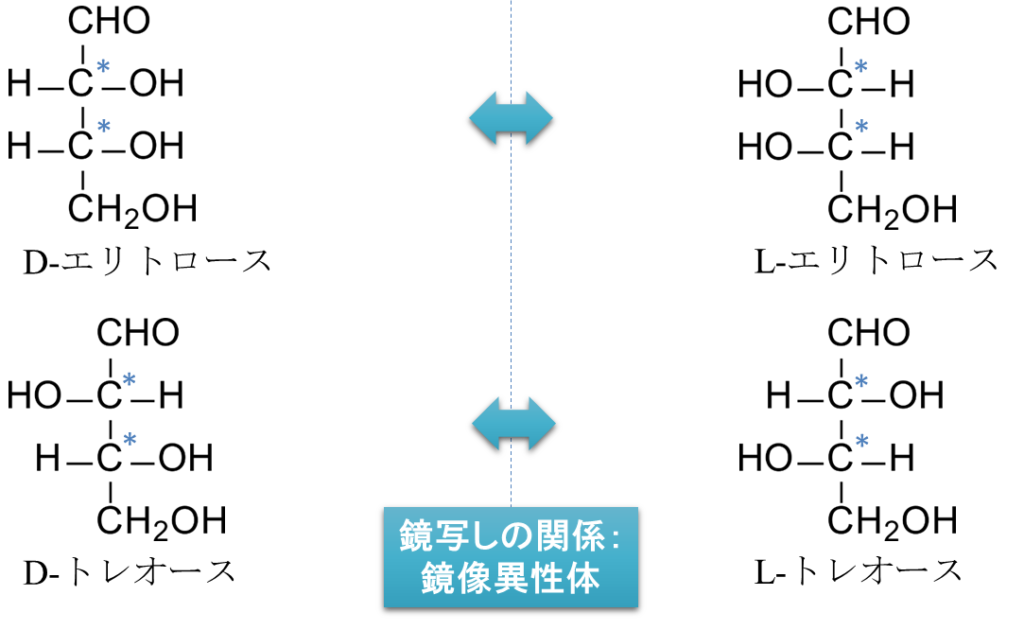
図2にエリトロースの構造を示しています。不斉炭素原子は、1つの化合物に複数含まれることがあります。エリトロースの場合、2 位と 3 位の炭素がそれぞれ不斉炭素原子です。
不斉炭素原子が n 個あるとき、存在し得る立体異性体の数は 2ⁿ 通りとなります。これは、それぞれの不斉炭素について2通りの立体配置(例えば、左右の置換基が入れ替わる配置)が考えられ、その組み合わせによって全体の構造が決まるためです。
エリトロースでは n = 2 なので、立体異性体は 2²=4 通り存在します(図2)。このうち、D-エリトロースと L-エリトロース、また D-トレオースと L-トレオースは、それぞれが互いに鏡写しの関係にあります。このような異性体を鏡像異性体といいます。
ジアステレオマー:鏡像異性体ではない立体異性体
また、D-エリトロースと D-トレオースや L-トレースのように立体異性体の関係にありながら、鏡像異性体の関係にないものをジアステレオマーといいます(図4)。鏡像異性体は化学的性質が同じ場合が多いですが、ジアステレオマーは異なる物性や化学的性質を持つ場合が多いです。
エピマーの定義とアノマーとの関係
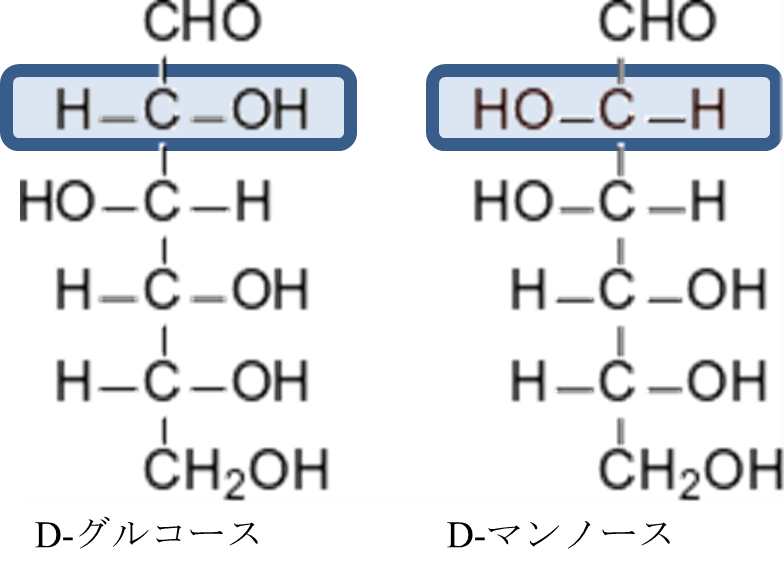
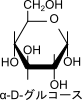
図3には α-D-グルコースと β-D-グルコースの構造を示しています。グルコースには複数の不斉炭素原子が含まれています。一方で α-D-グルコースと β-D-グルコースでは 1 位の水酸基のみが置換しています(図5)。このように、複数の不斉炭素原子が含まれている分子で一つの炭素の立体配置のみが異なっている関係のことをエピマーといいます。
ここで以前に紹介したアノマーと混同しそうなので、追加で説明します。アノマーとは鎖状の単糖が環状構造をとる際に発生する立体異性体のことを言います。このことから、α-D-グルコースとβ-D-グルコースはアノマーでもあります。一方でエピマーとは一つの不斉炭素でだけ立体配置が異なっている関係のことを言います。D-グルコースと D-マンノースは 2 位のエピマーですが(図4)、それぞれの鎖状構造が環状構造をとったところでグルコースはマンノースにはならないですし、逆もまた起こりません。したがって、アノマーではありません。ちょっと概念が似ているように見えますが、定義が違いますので混同しないように気を付けてください(図6)。
D 体、L 体の命名の見分け方と定義
最後にこれまで何気なく登場してきた “D-“、”L-” の表記について記載します。判定の手順は次の通りです。アルデヒド基(ケト基)を上に配置して、最も遠くにある不斉炭素原子に注目します。この炭素の水酸基が右に来る場合を D 体、左に来る場合を L 体といいます(図7)。
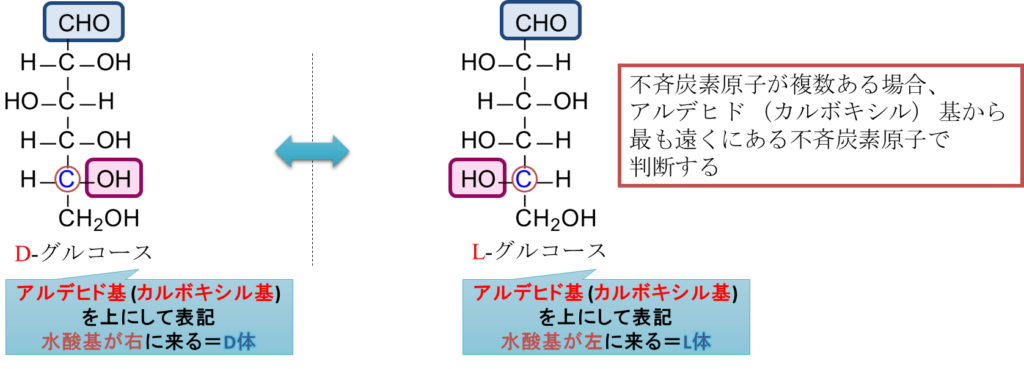
そもそも、D 体、L 体はどのように定義づけられるのでしょうか?この命名法はグリセルアルデヒドを基準に決めています。グリセルアルデヒドの旋光度を測定した場合に偏光面を時計回りに回転させる(dextro-rotatory)立体異性体を d-グリセルアルデヒドあるいは (+)-グリセルアルデヒドと表記します。一方で 偏光面を反時計回りに回転させる(levo-rotatory)物は l-グリセルアルデヒドあるいは (-)-グリセルアルデヒドと表記されます。ここで注意すべき点は、d/l 表記が旋光方向を示す点にあります。ここで、d-グリセルアルデヒドや l-グリセルアルデヒドをそれぞれ D-グリセルアルデヒド、L-グリセルアルデヒドと表記することにします。この対応関係を命名規則として拡張したのが、現在の D/L 表記です。この d-グリセルアルデヒドを D-グリセルアルデヒド、l-グリセルアルデヒドを L-グリセルアルデヒドとします。
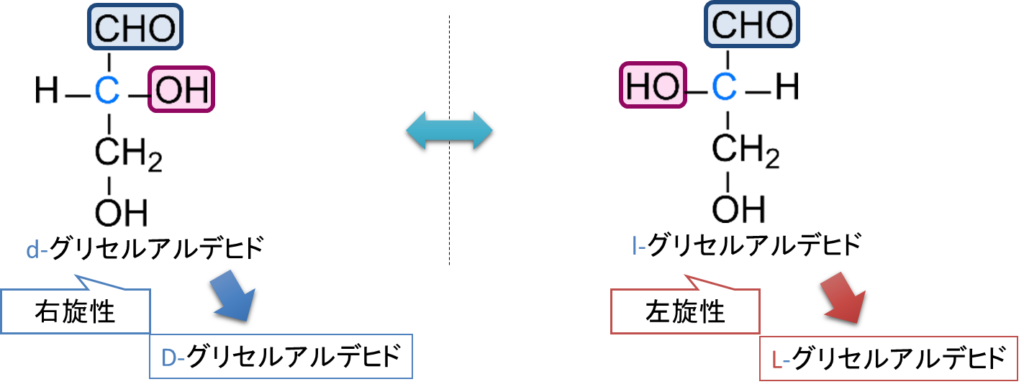
図6に D-グリセルアルデヒドと L-グリセルアルデヒドの構造を示します。グルコースの場合、ホルミル基とこの不斉炭素の間に炭素鎖を挿入することでグリセルアルデヒドから誘導されると考えられます。このとき、グリセルアルデヒドの不斉炭素に対応する位置はグルコースではホルミル基から最も遠い5位炭素にあたります。したがって、この炭素に結合する水酸基の向き(右か左か)を見れば、グルコースが D 体か L 体かを判別できます。
最後にもう一度強調しておくと、D/L 表記は旋光方向(右旋・左旋)とは無関係です。あくまで「どちらのグリセルアルデヒドに由来する立体配置をもつか」に基づいて命名されています。
ピラノースの立体構造
ピラノースの立体構造:いす形配座と舟形配座
図7に六員環の構造を示しています。炭素原子は正四面体の頂点方向に結合の手が伸びている構造をしています。この炭素を組み合わせると、図7のようないす形と舟形の構造が考えられます。舟形の構造は炭素が同じ側に集中していて、少し窮屈な構造となります。
図中の “a” と “e” はそれぞれ置換基の位置を示しており、“a”(アキシアル結合)は分子面(図中黄色い面)に対して垂直方向、“e”(エクアトリアル結合)は平行方向を意味します。舟形構造ではアキシアル結合が近接して立体的に混み合うため、原子間の反発(立体障害)が大きくなります。立体障害とは、このように原子や置換基が互いに近づきすぎて反発し、分子が不安定になる現象を指します。そのため、いす形構造の方が立体的に安定です。
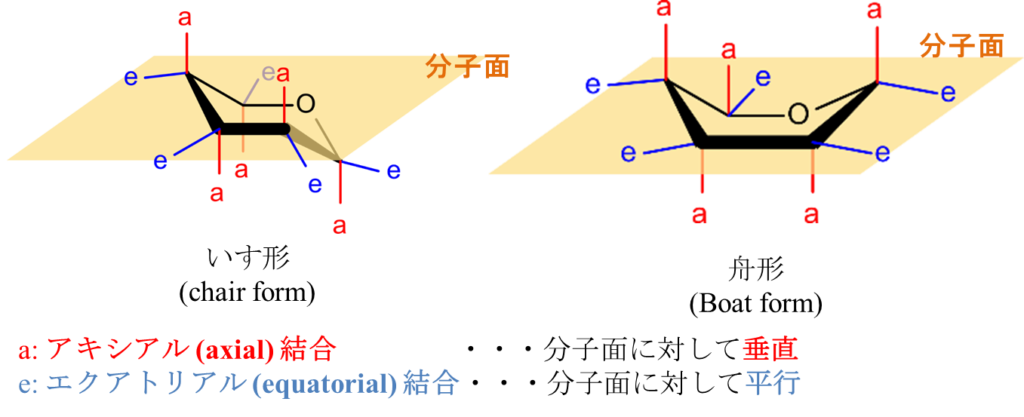
次に、ピラノース(六員環単糖)のいす形構造では、C1 配座と 1C 配座の2種類の配座が存在します(図8)。どちらが安定かは、各置換基がアキシアル結合かエクアトリアル結合かによって決まります。一般に大きな置換基(OH 基や CH₂OH 基)はアキシアル結合の位置にあると立体障害を引き起こすため、エクアトリアル結合にある方が安定です。
C1 配座と 1C 配座の安定性
ピラノース(六員環を形成する単糖)のいす型配置では C1 配座と 1C 配座をとりえます(図9)。これらの配座の内、立体障害が起こりにくいほうが安定です。D-グルコースの各配座でそれぞれの OH 基や CH2OH 基がアキシアル結合かエクアトリアル結合のいずれをとるかを表1にまとめてみました。
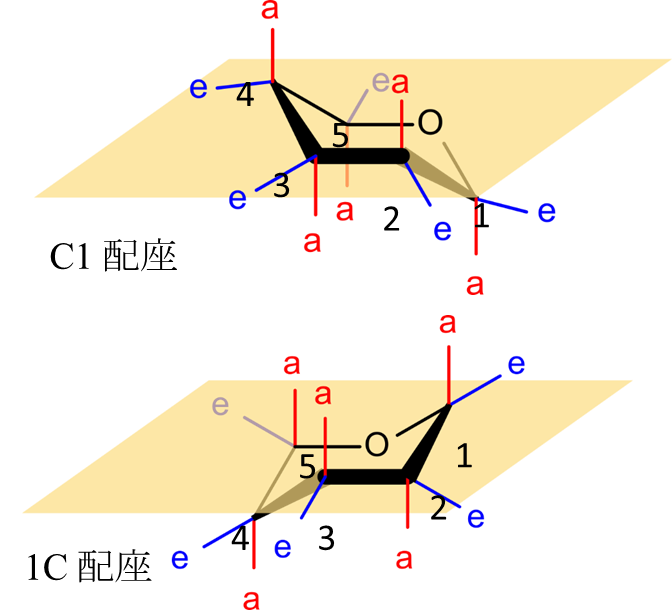
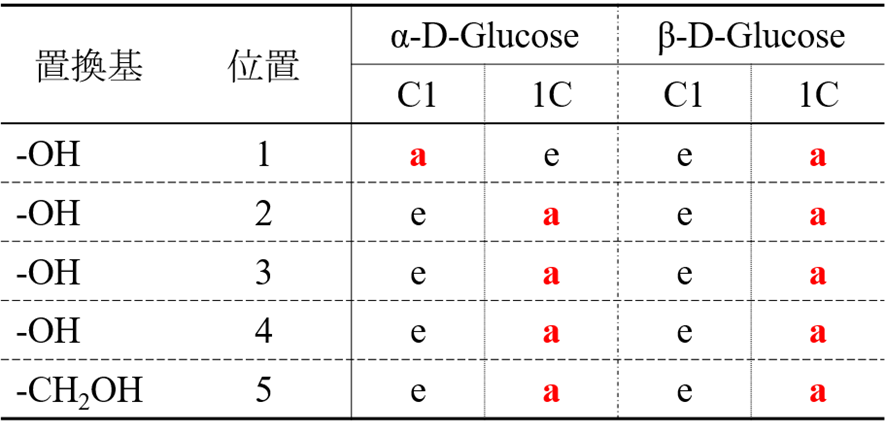
α-D-グルコースでは、C1 配座をとると1位の水酸基を除いてすべてエクアトリアル結合をとります。一方で 1C 結合は逆に1位の水酸基だけがエクアトリアル結合であり、そのほかはアキシアル結合をとります。アキシアル結合は立体障害を起こしやすいため不安定になりまので、α-D-グルコースでは C1 配座をとります。同様に β-D-グルコースで、C1 配座をとった場合すべての置換基がエクアトリアル結合をとるのに対し、1C 配座ではすべてアキシアル結合となりますので、C1 配座が安定です。このようにC1 配座と 1C 配座の内どちらが安定かは立体構造によって決まります。
立体構造の安定性と α 体と β 体の存在比
このような配座の安定性は、溶液中における α 体と β 体の平衡比にも影響します。α-D-グルコースで C1 配座をとると1位の水酸基を除いてすべてエクアトリアル結合をとるのに対して、β-D-グルコースで、C1 配座をとった場合すべての置換基がエクアトリアル結合をとります。このため、β-D-グルコースは、α-D-グルコースよりも安定です。また、グルコースの水溶液を放置すると β-D-グルコースの方が α-D-グルコースよりも多くなりますが( α-D-グルコース:β-D-グルコース=37:63)、これも、β-D-グルコースの方が安定だからです。
分子の立体構造と安定性
最後にグルコースの立体構造についてみていきましょう。D-グルコースは最も安定した単糖です。そのため、D-グルコースはもっともありふれた糖として知られています。これはなぜでしょうか?
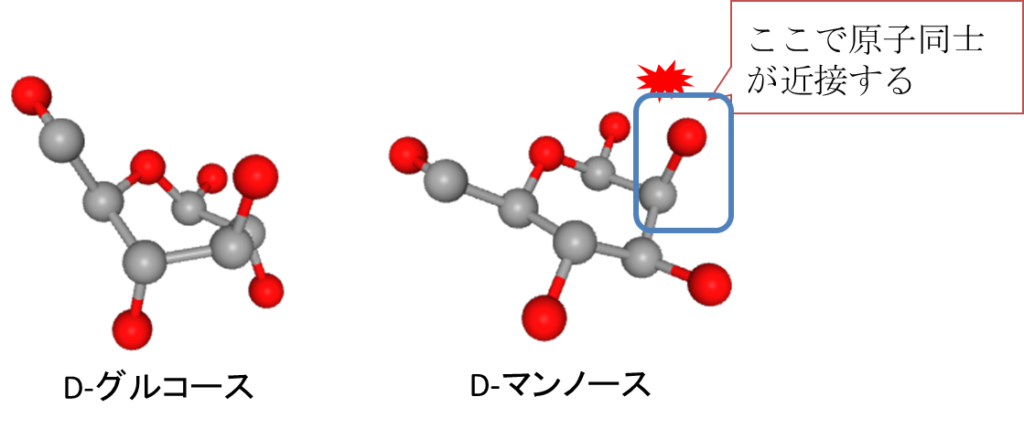
図10に示すようにD-グルコースでは赤色で示した水酸基がバラバラな方向に散っています。このため立体障害が起こりにくい構造をとっており、D-グルコースは非常に安定した構造をとっています。一方でマンノースは水酸基が2位の水酸基が反転しており(青枠)、1位の水酸基(図でいうと左隣の水酸基)と位置が近づいてしまいます。この差が立体障害を生じることとなり、マンノースはグルコースより少し不安定になります。とはいえ、他の部位ではこのような立体障害が起きていないので、比較的安定な構造をとっています。D-グルコースとそれに類似した単糖が安定しているといったのは、このような立体障害の少なさが理由です。
練習問題
設問
D-グルコースのジアステレオマーを、次のタイルから1つ選びなさい。
設問
以下の4つのタイルをα-D-グルコースの「アノマー」「エピマー」「ジアステレオマー」の各枠に分類しなさい。
※ドラッグ&ドロップ、またはタイルをタップ→枠をタップでも配置できます。
設問
以下の単糖タイルを「D 体」「L 体」の各枠に分類しなさい。
※ドラッグ&ドロップ、またはタイルをタップ→枠をタップでも配置できます。
設問
次の3つの単糖タイルを「C1 配座の方が安定」「1C 配座の方が安定」の各枠に分類しなさい。
※ドラッグ&ドロップ、またはタイルをタップ→枠をタップでも配置できます。
今回は糖の立体構造についてまとめてみました。この記事では、キーとなる不斉炭素と立体異性(鏡像異性体/ジアステレオマー)、エピマーとアノマー、D/L 表記、そしてピラノースのいす形・舟形や C1/1C 配座まで体系的に整理しました。特に、糖の安定性や不安定性にかかわる議論は糖化学でも重要な概念の一つです。
また、立体構造をイメージしながら理解できるように図解を中心に構成しています。ぜひ重要図を見返しながら復習し、関連トピック(変旋光、還元性、グルコース/マンノースのエピマー関係、環化機構)へと学びを広げてみてください。
参考文献
- K. P. C. Vollhardt, N. E. Schore著、古賀憲司、野依良治、村橋俊一、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人訳 (2020). ボルハルト・ショアー現代有機化学 第8版. 化学同人. pp. 1425-1486
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 5-34
- 2.Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 290-313
- John McMurry著、伊東椒、児玉三明訳 (2000). マクマリー有機化学 第4版. 東京化学同人. pp. 439-470
関連記事
糖鎖の基本について
糖鎖の化学反応について
オリゴ糖・多糖について
解糖系について
- 解糖系(glycolysis)によって糖からエネルギーを取り出しATP を生成する
- 解糖系の各反応をエネルギー的観点から読み解く
- 解糖系で利用される糖はグルコースに限らない
- 解糖系の制御は三つの律速酵素に対する調節で行われる
TCA サイクルについて