ケトン体は、飢餓や糖尿病で注目される重要な代謝産物です。脂肪酸の酸化で生じたアセチル CoA が TCA 回路に入りにくくなると、肝臓でケトン体へ変換されます。ケトン体は血流に乗って脳や心筋へ運ばれ、主要なエネルギー源として利用されます。この過程はパン作りと似ています。脂肪酸は小麦の様なもので分解するとアセチル CoA となり、これは小麦粉に相当します。小麦粉も利用することはできますが、利用しやすいわけではありません。同様にアセチル CoA も利用できない組織があり、利用しやすいというわけではありません。小麦粉を利用してパンにするとどんな人でも簡単に食べることができますが、ケトン体生成はパンを焼く行為に似ていて、ケトン体を生成することでいろんな組織が利用可能となります。この記事では、その生成と利用の仕組みを解説します。

Contents
ケトン体生成
脂肪酸の酸化によって生じたアセチル CoA は、通常 TCA 回路に取り込まれ、そこで NADH、FADH2、GTP が生成されます。これらの NADH、FADH2 は電子伝達系を介して ATP 合成に用いられるため、アセチル CoA はエネルギー産生に重要な役割を果たします。
一方、アセチル CoA が TCA 回路に入るためには縮合相手となるオキサロ酢酸の十分な供給が必要です。しかし、飢餓状態(グルコース不足)や糖尿病(脂肪分解と糖新生が亢進している状態)の肝臓では、オキサロ酢酸が糖新生(グルコース合成)に消費されるため、枯渇してしまいます。その結果、アセチル CoA は TCA 回路で処理されにくくなり、余剰分は肝臓でアセト酢酸や D-3-ヒドロキシ酪酸などのケトン体(ketone body)へ変換されます。生成したケトン体は末梢組織でエネルギー源として利用されます。

通常時には、グルコースが分解されてピルビン酸が生成され、ピルビン酸カルボキシラーゼの作用によってオキサロ酢酸に変換されます(黄色矢印)。このオキサロ酢酸は、アセチル CoA をTCA回路へ取り込む際に必須となります(オレンジ矢印)。
一方、飢餓条件下では脂肪酸のβ酸化によってアセチル CoA が大量に供給されますが、グルコース不足のためオキサロ酢酸の供給が減少します(黄色破線矢印)。さらに、残り少ないオキサロ酢酸は糖新生に利用されてグルコース合成へ回されるため(青色矢印)、TCA回路でアセチル CoA を効率よく利用できなくなります(オレンジ破線矢印)。その結果、余剰となったアセチル CoA はケトン体生成に振り向けられ、末梢組織へ供給されます。
ケトン体生成経路
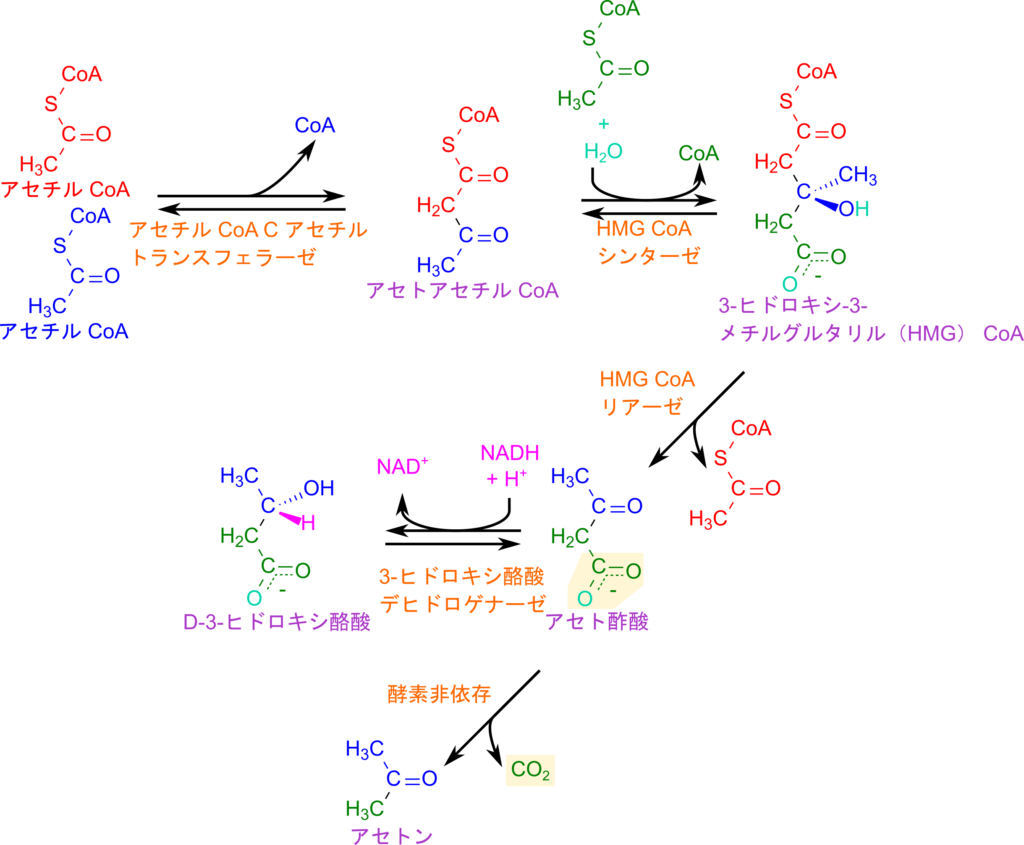
ケトン体の生成は、まず 2 分子のアセチル CoA が縮合して CoA が遊離し、アセトアセチル CoA が生成される反応から始まります。この反応は β 酸化の最終段階と同型であり、触媒酵素も同じアセチル CoA C-アセチルトランスフェラーゼ(チオラーゼ)が用いられます。次に、もう 1 分子のアセチル CoA と水が加わり、3-ヒドロキシ-3-メチルグルタリル CoA(HMG-CoA)が生成されます。この反応は HMG-CoA シンターゼによって触媒されます。HMG-CoA は HMG-CoA リアーゼの作用により開裂し、アセチル CoA が遊離してアセト酢酸が生成されます。
アセト酢酸は 3-ヒドロキシ酪酸デヒドロゲナーゼによって D-3-ヒドロキシ酪酸に変換され、この反応では NADH が酸化され NAD⁺ が再生されます。一般に「ケトン体」とは、アセト酢酸と D-3-ヒドロキシ酪酸を指し、その比率は細胞内の NADH/NAD⁺ 比に依存します。このことは二分子の変換に NADH が関与することから想像がつくかと思います。さらに、アセト酢酸は自発的に脱炭酸を起こし、炭酸ガスを放出してアセトンへと変換されます。
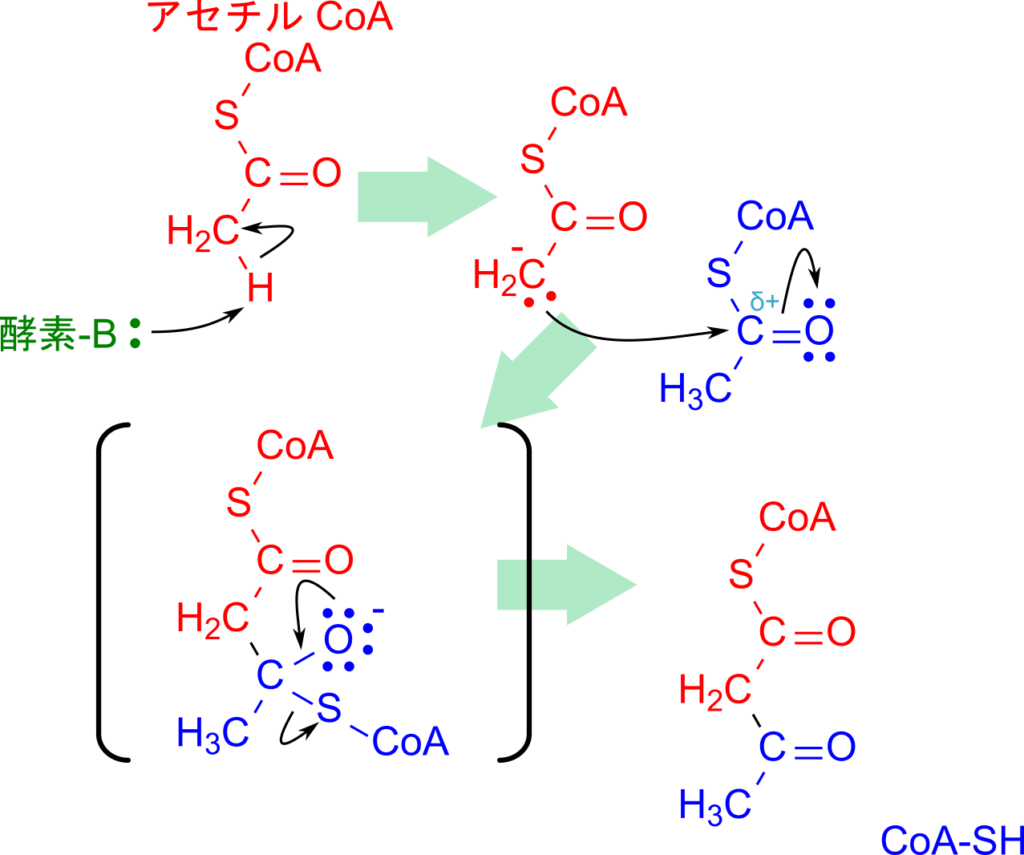
アセチル CoA 同士の縮合を見ていきましょう。この反応は β 酸化における 3-オキシアシル CoA の開裂反応と同様に、アセチルCoA C-アシルトランスフェラーゼ(チオラーゼ)によって触媒されます。つまり、両者は同じ種類の酵素が触媒する反応であり、本質的には逆方向の反応にあたります。アセチル CoA を「炭素鎖が 1 つしかないアシル CoA」とみなすと、その対応関係が理解しやすいでしょう。
この反応は有機化学で基本となるクライゼン縮合によって進行します。まず、酵素がアセチル CoA のメチル基からプロトンを引き抜き、エノラートアニオンが形成されます。このアニオンの炭素が、別のアセチル CoA のカルボニル炭素を求核攻撃し、新たな C–C 結合が生じます。これにより、最終的にアセトアセチル CoA が生成されます(図3)。
クライゼン縮合は生化学の多くの代謝経路で繰り返し登場するだけでなく、有機化学における代表的な反応機構でもあるため、しっかり理解しておくことが重要です。
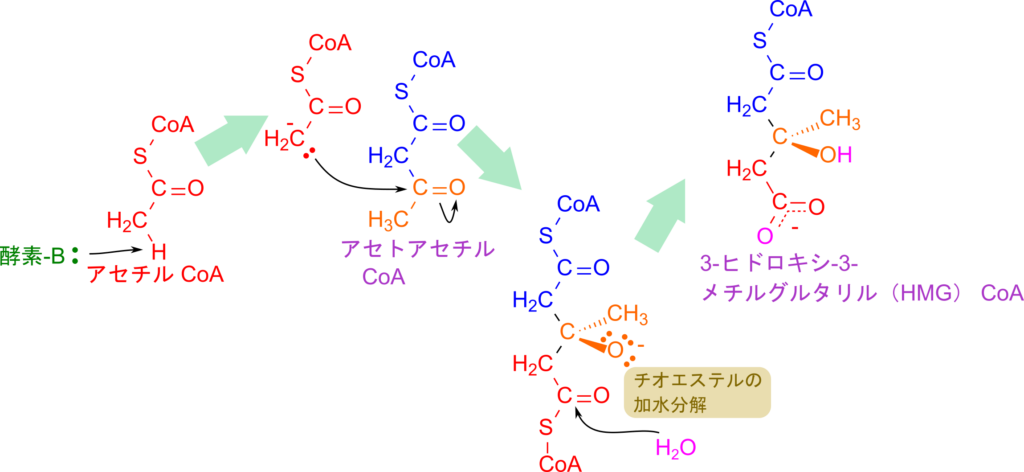
次に、3-ヒドロキシ-3-メチルグルタリル(HMG)CoA の生成について解説します。この反応はアセトアセチル CoA の生成と類似しており(クライゼン縮合)、まずアセチル CoA のメチル基から酵素がプロトンを引き抜くことで開始します。生成したエノラートアニオンがアセトアセチル CoA のカルボニル炭素を求核的に攻撃し、新しい C–C 結合が形成されることで HMG-CoA が生成されます。
この反応がアセチル CoA 同士の縮合と異なるのは、攻撃を受けたカルボニル基の酸素がそのまま水酸基(ヒドロキシ基)として残る点です。また、CoA を遊離させる過程では水分子の付加によるチオエステルの加水分解が利用されます。チオエステル結合の加水分解は発エルゴン反応(ΔG°′ < 0)であるため、進行しやすい反応となります。一方、その前段階であるアセトアセチル CoA の生成は平衡が左(アセチル CoA 側)に偏っています。したがって単独では進行しにくい反応です。しかし、生成したアセトアセチル CoA は次の HMG-CoA 合成反応で速やかに消費されるため、実際には問題なくアセトアセチル CoA の生成が進みます。このように、個々の反応単体では不利に見えても、代謝経路全体としては有利に進むというのは生化学反応の大きな特徴の一つです。
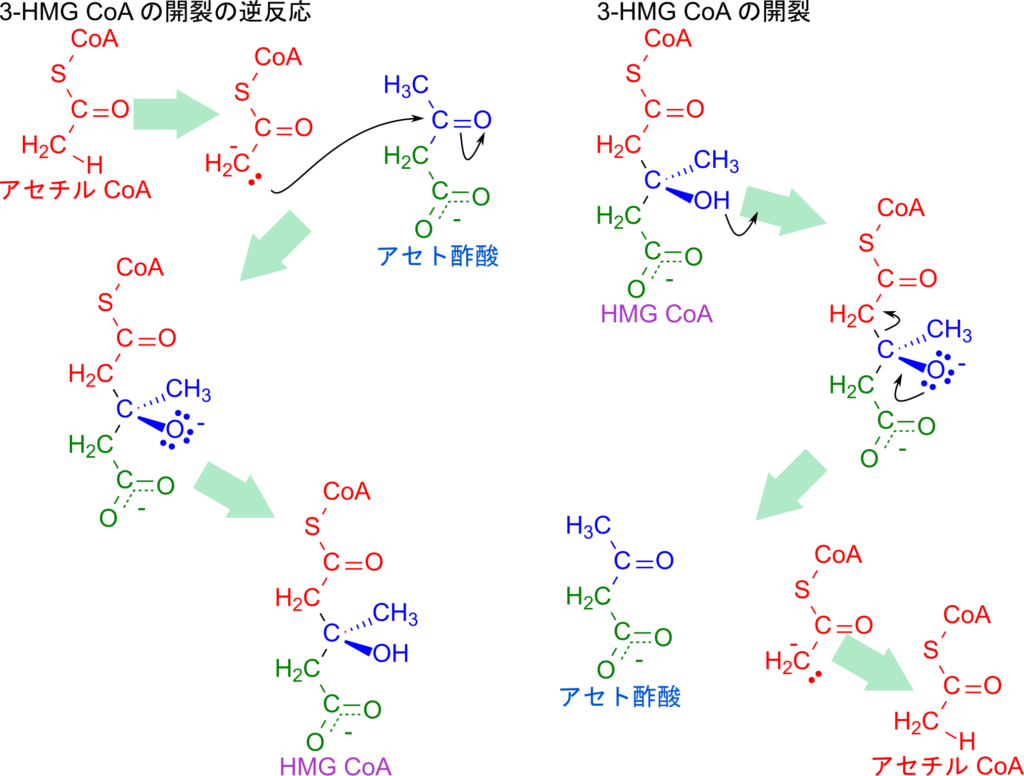
最後に、HMG-CoA の開裂について解説します。この反応はクライゼン縮合の逆反応として進行します。まず、HMG-CoA の 3-ヒドロキシ基が脱プロトン化されてカルボアニオンが形成され、それに伴って C–C 結合が開裂します。その結果、アセト酢酸とアセチル CoA のエノラートイオンが生成されます。続いて、このエノラートイオンがプロトンを受け取り、安定なアセチル CoA へ変換されることで反応が完結します。
この反応を逆方向から眺めると、アセチル CoA がまずエノラートイオンに変換され、その炭素がアセト酢酸のカルボニル基を求核攻撃して新たな C–C 結合を形成します。これはまさに典型的なクライゼン縮合に相当します(図5)。
アセチル CoA から HMG CoA の流れがスムーズに進行する理由
本文でも説明しましたが、イメージを補うために追加の解説を示します。
アセチル CoA からアセトアセチル CoA を経て 3-ヒドロキシ-3-メチルグルタリル(HMG)CoA に至る経路は、水路にたとえると直感的に理解しやすくなります。図6を見てください。この図では、基質や生成物は水路を流れる水とみなし、その濃度は水量で表します。また、各分子の化学ポテンシャルは水路の底の高さとして表現します。
まず、アセチル CoA からアセトアセチル CoA への反応は平衡が左に偏っており(平衡定数が小さい)、進みにくい反応です。図では、アセトアセチル CoA+CoA の底面がアセチル CoA よりも高い位置にあることで示されています。そのため、この反応はアセチル CoA が十分に蓄積されないとほとんど進行せず、アセトアセチル CoA の水位も高まりにくい状態にあります。少し供給されてもすぐに流れが止まってしまうのです。
ただし、水は常に双方向に動くように、化学反応も正反応と逆反応が同時に起こっています。見かけ上「反応が進んでいない」と見えるのは、正反応と逆反応の速度が釣り合った平衡状態だからです。このとき水位の変化が止まるように、濃度の変化も見られなくなります。
一方、アセトアセチル CoA から HMG CoA への反応は平衡が右に偏っており(自由エネルギー的に有利)、進みやすい反応です。これは、HMG CoA の底面がアセトアセチル CoA より低い位置にあることで表現されています。そのため、アセトアセチル CoA がいったん生成されるとすぐに HMG CoA へと流れ込みます。その結果、アセトアセチル CoA の水位は常に低く保たれ、アセチル CoA の流入が促進されることになります。
このように、水路の比喩を用いることで、アセチル CoA から HMG CoA への経路がなぜスムーズに進むのかを直感的に理解できるでしょう。
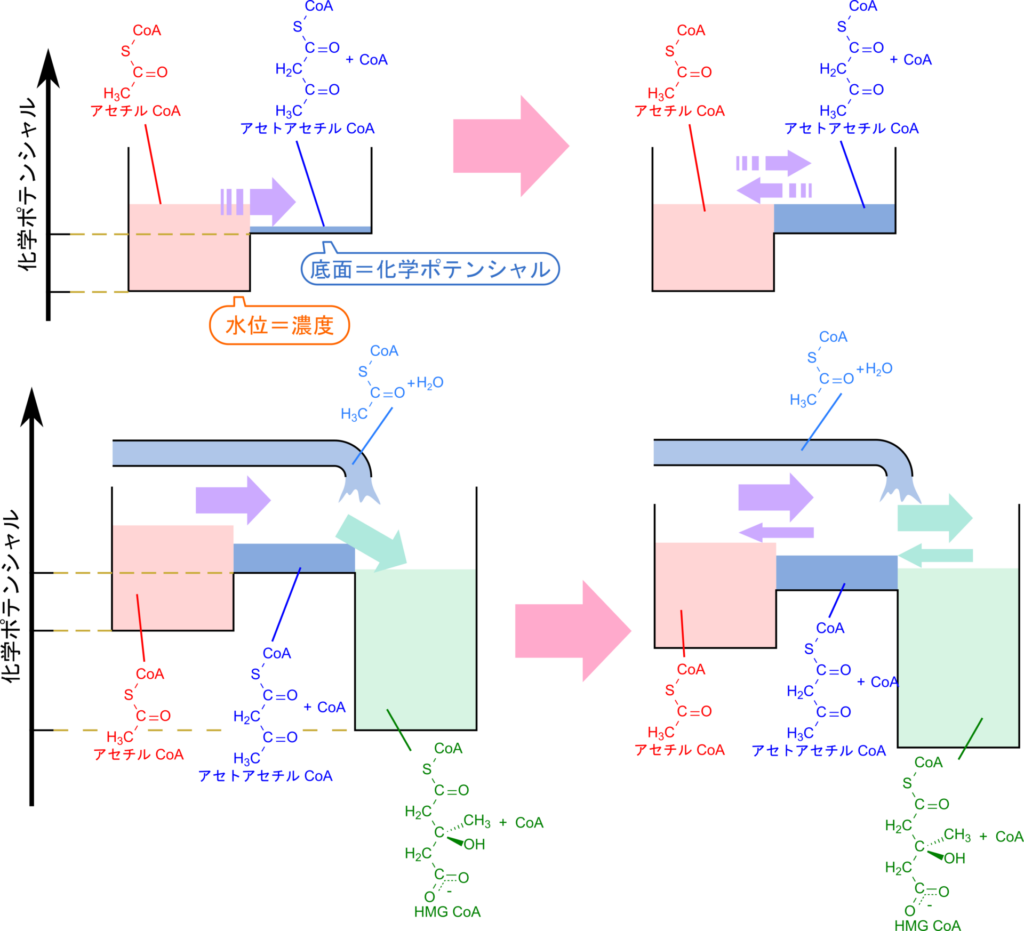
この図では、水位を基質や生成物の濃度、各水路の底面の高さを各段階の化学ポテンシャルとして表現しています。反応の進みやすさは前後の底面の高低差によって決まり、生成物側が低ければ進みやすく、高ければ進みにくくなります。
ケトン体の利用
ケトン体の分解
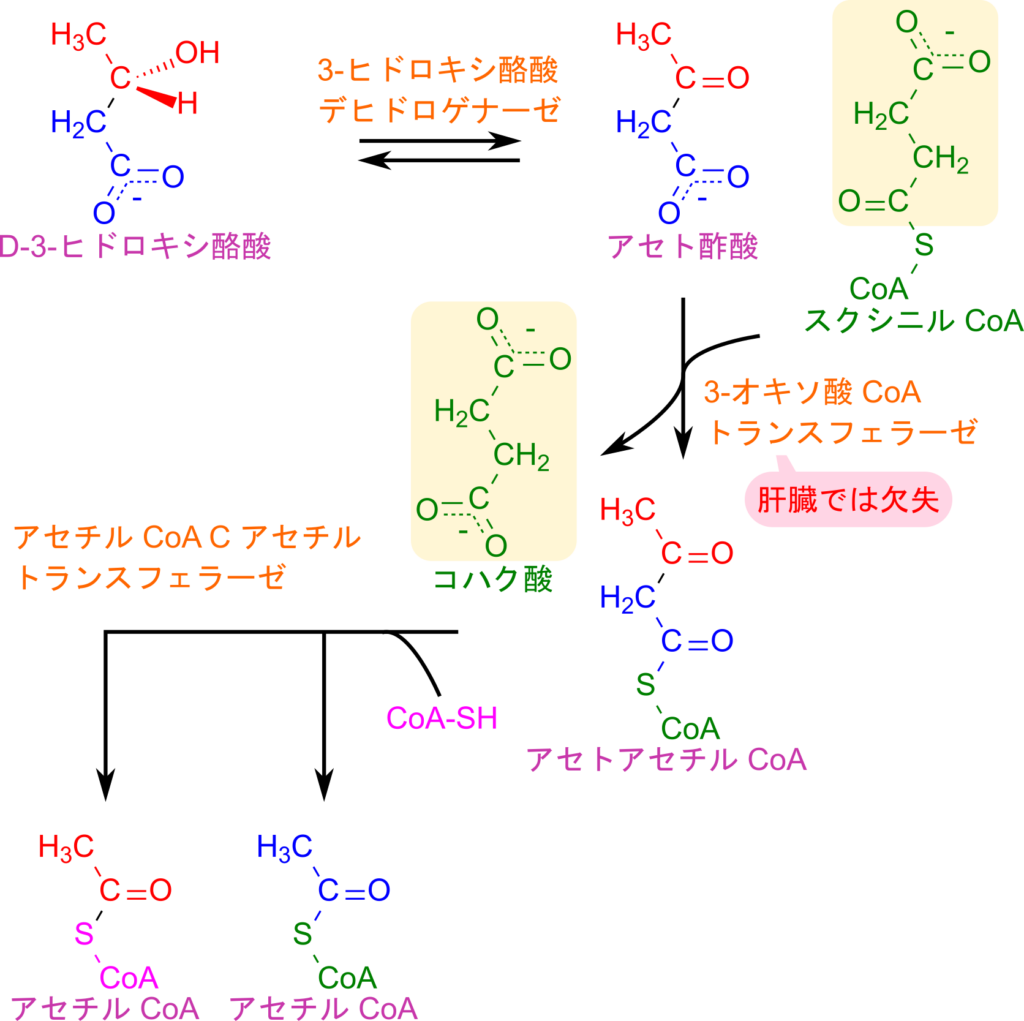
肝臓で生成されたケトン体は血中に放出されたのち、心筋や腎臓などの末梢組織に取り込まれて TCA 回路に利用されます。D-3-ヒドロキシ酪酸は 3-ヒドロキシ酪酸デヒドロゲナーゼの作用によってアセト酢酸に酸化されます。この反応は、ケトン体生成で行われるアセト酢酸から D-3-ヒドロキシ酪酸への還元反応の逆反応です。生成した、あるいは肝臓から供給されたアセト酢酸は、スクシニル CoA から CoA を受け取ってアセトアセチル CoA に変換され、その際にスクシニル CoA はコハク酸へと変換されます。続いてアセトアセチル CoA は、アセチル CoA C-アセチルトランスフェラーゼの作用によりクライゼン縮合の逆反応として開裂して、アセチル CoA 二分子を生じます。
このように、ケトン体が末梢組織でアセチル CoA に変換される過程は、基本的にケトン体生成の逆反応に相当します。ただし、アセト酢酸をアセトアセチル CoA に変換する段階だけは異なり、この反応は 3-オキソ酸 CoA トランスフェラーゼによって触媒されます。肝臓ではこの酵素を欠失しているため、肝臓はケトン体を消費できず、末梢組織にケトン体を供給する役割を担うことになります。
脂肪酸の利用とケトン体生成及び利用
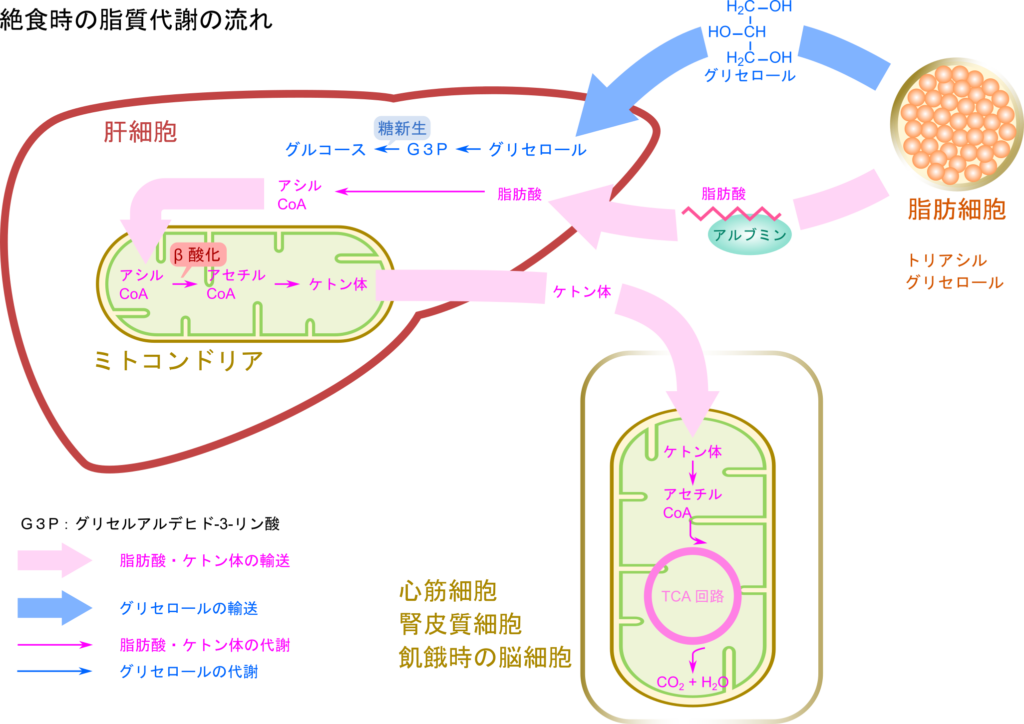
飢餓状態に陥った場合、グルコースのような即効性のエネルギー源の供給は望めません。こんな時は脂肪細胞に蓄えられた脂肪が分解され、脂肪酸とグリセロールが循環に乗って供給されるようになります(詳細はこちら)。その後の脂肪の運命についてみていきましょう。
脂肪が分解されるとグリセロールと脂肪酸が生成されます。いずれも血中に放出され、肝臓へ輸送されます。肝臓に取り込まれると、グリセロールはグリセルアルデヒド-3-リン酸(Glyceraldehyde-3–Phosphate;G3P)を経て糖新生に利用され、グルコースに変換されます。一方で脂肪酸はアシル CoA シンテターゼの作用によりミトコンドリア外膜で CoA が付加されてアシル CoA となり、カルニチンとトランスロカーゼを利用してミトコンドリアのマトリックスに輸送されます(詳細はこちらの記事で紹介しています)。その後、β 酸化によりアセチル CoA に変換されます(基本はこちらとこちらの記事で詳説しています)。飢餓状態や糖尿病患者のような条件下ではアセチル CoA の供給が過剰となるため、生成されたアセチル CoA はアセト酢酸や D-3-ヒドロキシ酪酸などのケトン体に変換されます。ところが、肝臓では 3-オキソ酸 CoA トランスフェラーゼを欠失しているためにケトン体をアセチル CoA に変換することができません。その結果、ケトン体は消費されることなく血中に放出されます。このように肝臓はケトン体を供給する役割を担います。ケトン体は末梢組織に輸送後、アセチル CoA に変換されたのち、TCA 回路で利用されることになります。
脳や赤血球では普段、グルコースをエネルギー源として利用していますが、脳では飢餓状態に至った場合にはケトン体を利用することになります。脳では飢餓状態が長期化した場合、必要となるエネルギー源の実に 75 % をケトン体で賄うようになります。一方で一部の組織では飢餓状態でなくともケトン体を主要なエネルギー源として利用します。このような組織で代表的なものは心筋と腎皮質で、これらの組織ではアセト酢酸を主要なエネルギー源として利用しています。
練習問題
今回はケトン体の生成と利用について整理しました。ケトン体は飢餓条件下のエネルギー代謝における中心的な概念であり、脂肪酸の酸化とも深く結びついています。肝臓で生成され、心筋や腎皮質、さらには長期飢餓時の脳で利用される一方、肝臓で生成されたケトン体は自身では利用できず、心筋や脳などエネルギー需要の高い組織に優先的に供給される仕組みを担っています。
このように、ケトン体生成と利用の理解は飢餓状態における代謝全体を把握するうえで欠かせません。ぜひ本記事を振り返り、代謝の全体像を整理してみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 190-207
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.440-476