脂肪酸はどのようにして脂肪細胞から放出され、ミトコンドリアでエネルギーとして利用されるのでしょうか?この記事では、GPCRによるシグナル伝達から細胞への取り込みやミトコンドリアへの輸送まで、脂肪酸代謝の流れをわかりやすく解説します。
Contents
脂肪酸の遊離と運搬
脂肪酸代謝の概要
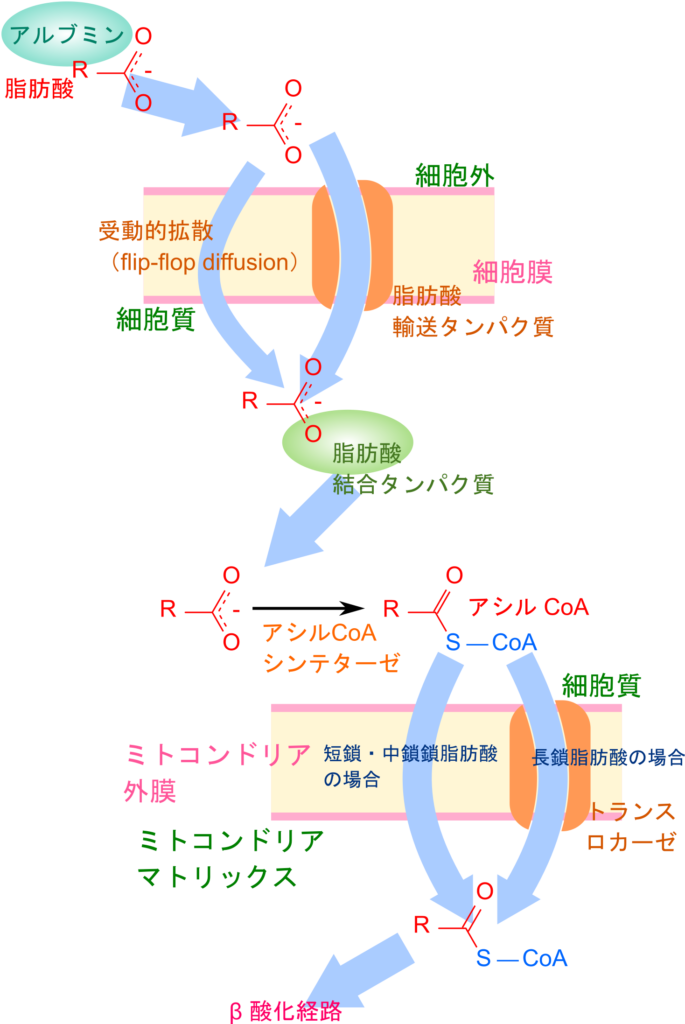
脂肪酸は普段、グリセロールと縮合したトリアシルグリセロールの形で脂肪細胞中に保存されています。糖のようなエネルギーが不足すると、脂肪細胞で脂肪酸がトリアシルグリセロールから切り出されてグリセロールと様々な長さの脂肪酸に分解されます。脂肪酸には短鎖脂肪酸(炭素数1~5)、中鎖脂肪酸(炭素数6~12)、長鎖脂肪酸(炭素数13~22)、超長鎖脂肪酸(炭素数22~)がありますが、その長さによって代謝経路が変わったり、輸送形態が変わります。脂肪細胞から放出された脂肪酸はそれ単体では血中に溶けだせないためアルブミンに結合して輸送されます。各組織に届けられると、CoA を付加されたのちに様々な経路で細胞に取り込まれます。細胞に取り込まれた脂肪酸は脂肪酸結合タンパク質と結合し、脂肪酸酸化の場であるミトコンドリアへ輸送されます。一方でグリセロールは肝臓や腎臓に運ばれて最終的にグリセルアルデヒド-3-リン酸に変換され、解糖系に利用されます。
脂肪酸は高度に還元された無水物であるため、内部には高いエネルギーを貯蔵しています。脂肪酸の完全酸化では約 38 kJ/g ものエネルギーを放出しますが、糖質やタンパク質では 17 kJ/g であり、この差は2倍以上にも達します。この大きな差は、糖質やタンパク質と比べて脂肪酸が高度に還元された無水物(酸素や二重結合などが極端に少ない構造をとっています)であるためです。
ホルモンによるシグナルと脂肪酸の放出
糖質など即効性のエネルギー源が枯渇している状況下ではグルカゴンやアドレナリンが分泌されています。これらのホルモンは7回膜貫通型のGタンパク質共役レセプター(G protein-coupled receptor;GPCR)によって認識されます。GPCR によって受け取られたホルモンによるシグナルは G タンパク質やアデニル酸シクラーゼの作用を経て cAMP の生成を経てプロテインキナーゼ A(PKA)の活性化を引き起こします(なお、この過程はとても重要な過程ですのでのちに詳述します。詳細はこちらを参照してください)。
こうして活性化された PKA はペリリピン(perilipin)とホルモン感受性リパーゼ(Hormone Sensitive Lipase;HSL)をリン酸化して活性化させます。
ペリリピンは以下の二つの機能を担っています。
- 脂肪滴(中性脂質の貯蔵体)の構造を変化させて脂肪酸を利用しやすくする
- 脂肪細胞特異的トリアシルグリセロールリパーゼ(ATGL; adipose triglyceride lipase)の活性化補助因子をペリリピンから遊離をさせて ATGL と結合させる
この結果、ATGL はトリアシルグリセロールから脂肪酸を一つ切り出してジアシルグリセロールを生成します。ジアシルグリセロールは HSL の作用によりさらに脂肪酸が一つ切り出されてモノアシルグリセロールに変換されます。最後にモノアシルグリセロールリパーゼから脂肪酸が切り出されてグリセロールと脂肪酸に分解されます(図1)。こうしてトリアシルグリセロールは脂肪酸とグリセロールに分解されて放出され、脂肪酸はアルブミンと結合して運搬され、エネルギー源を必要とする各組織へ運搬され、グリセロールは肝臓や腎臓に運ばれます。それぞれの分子はさらなる異化を経て、それぞれエネルギー代謝に利用されます。
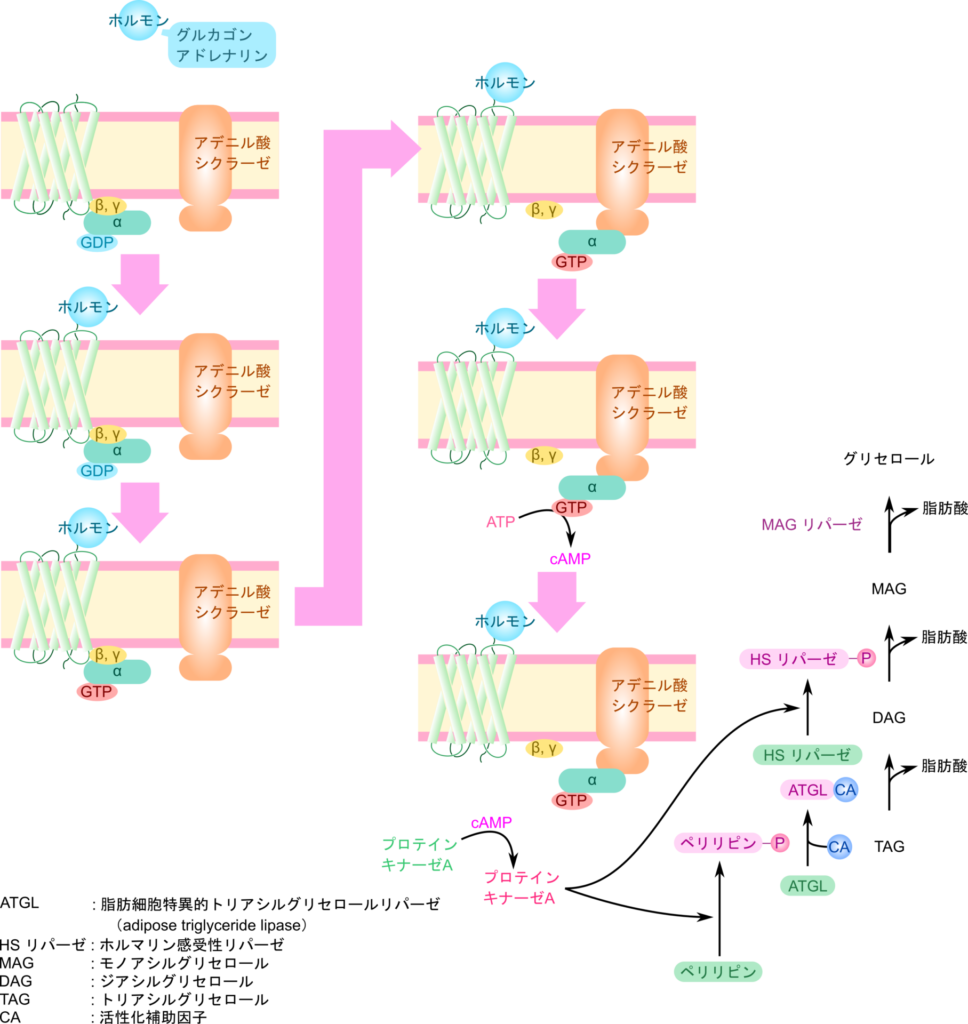
Gタンパク質共役レセプター(G protein-coupled receptor;GPCR)によるシグナル伝達
GPCR は G タンパク質と互いに相互作用しながら機能を果たしています。G タンパク質は α、β、γ サブユニット(それぞれ Gα、Gβ、Gγ と記載されることもあります)から構成されたヘテロ三量体であり、α サブユニットはグアニジンヌクレオチド(GDP)と結合しています。ホルモンを GPCR が受け取るとα サブユニットの GDP は GTP へ交換されます(「交換」であって「リン酸化」ではありませんの注意してください。GDP が外れて、GTP が代わりに付加されます)。この時、GPCR は GDP/GTP の交換反応を触媒しますが、この作用はホルモンのシグナルを増幅機能も担っています。GDP が GTP に交換されると α サブユニットは βγ サブユニットから解離して α サブユニットがアデニル酸シクラーゼまで移動し、結合します。するとアデニル酸シクラーゼが活性化され、ATP を cAMP に変換する反応を触媒するようになります。ここで多数の cAMP が産生されることで、さらにシグナルが増幅されます。産生された cAMP がプロテインキナーゼ A(protein kinase A;PKA)に結合すると PKA が活性化されて下流のタンパク質をリン酸化できるようになります。こうして GPCR が受け取ったシグナルは様々なタンパク質のリン酸化などを経て細胞内に伝達されていきます。ところで、活性化を受けた状態では α サブユニットの GDP は GTP に交換された状態となっています。このままではあまりに過大なシグナルが伝達されてしまいます。ところが α サブユニットにはそれ自体が GTP を脱リン酸化して GDP に変換する GTP アーゼ活性を持っており、数秒~数分の時間をかけてゆっくりと GDP へ変換していきます。GDP に変換されると α サブユニットは活性を失ってシグナルを伝達しなくなります。つまり、α サブユニットはタイマー付きの分子であり、一度活性化を受けても一定時間以上は活性を発揮できないようになっています。その後、βγ サブユニットと再会合して G タンパク質は元の状態に戻ります。一方で GPCR 自身もホルモンが解離するか、GPCR の C 末端がリン酸化されることでレセプター自体が不活性化されることでレセプターによる G タンパク質の活性化は停止します。ところで、ここでは脂肪酸の遊離を介在するシグナルの受容体として紹介していますが、GPCR は G タンパク質と共役している一群のレセプターのことを意味しており、光受容体やにおい分子、味覚分子、神経伝達物質など様々な分子を受け取ることが知られています。ここで紹介した GPCR の作用メカニズムは様々な場面で活用されている仕組みですのでぜひしっかりと理解してください。
グリセロールの輸送と代謝
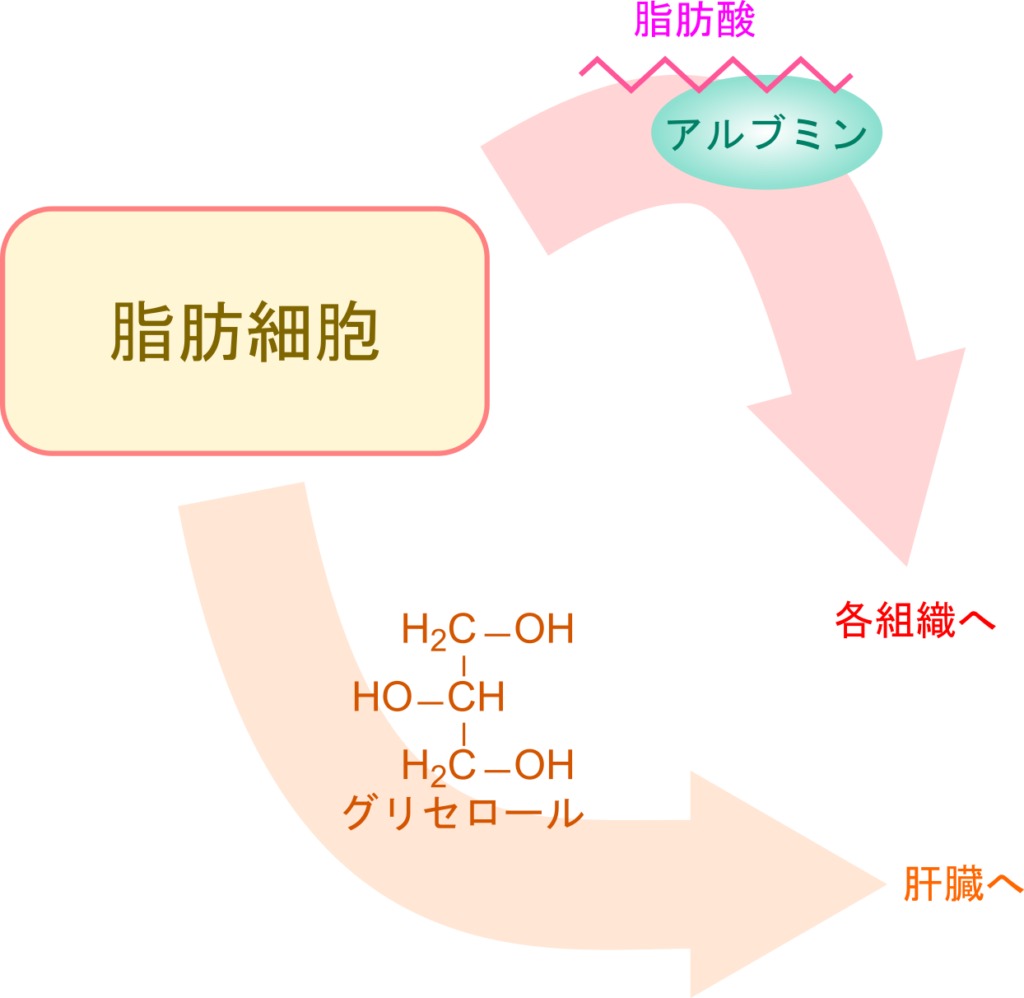
脂肪細胞から放出された脂肪酸はそれ自体では血中にとけだせないため、アルブミンに結合して運搬されます。脂肪酸は各組織でエネルギー源として利用されるため、エネルギーを必要とする各組織へ運搬されます。一方で、グリセロールは循環に乗って運搬され、肝臓や腎臓に運ばれ処理されます。
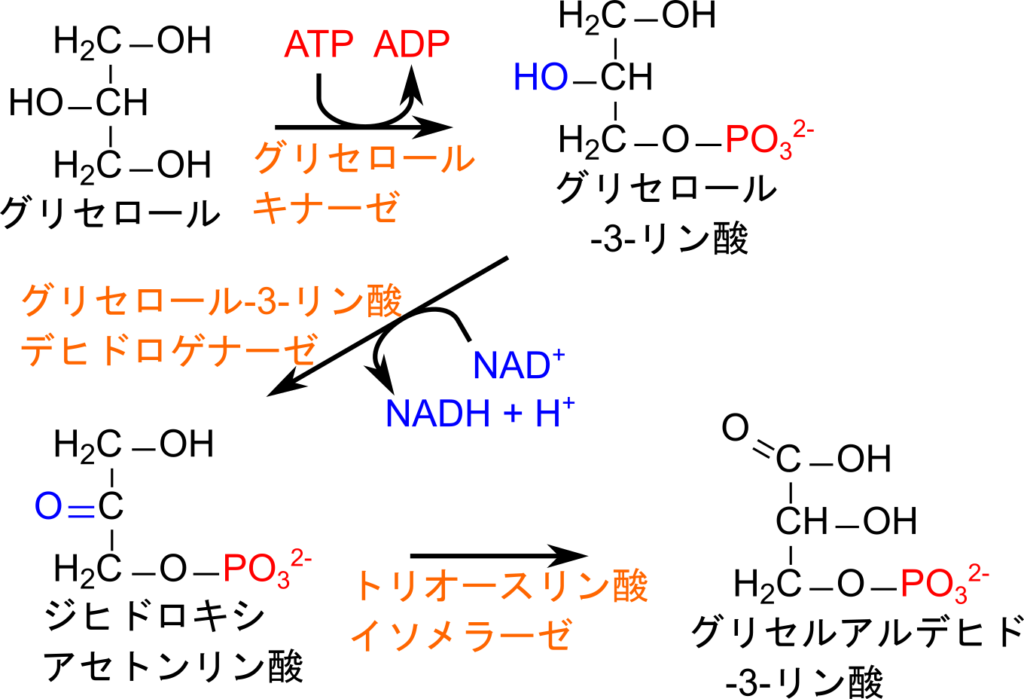
グリセロールが肝臓に運ばれると、グリセロールキナーゼの作用により ATP を利用したリン酸化を受けます。その後、グリセロール-3-リン酸デヒドロゲナーゼの作用により 2 位の水酸基が酸化されてジヒドロキシアセトンリン酸が生成されます。最後にトリオースリン酸イソメラーゼの作用によりグリセルアルデヒド-3-リン酸に変換されます。最後の反応は解糖系でも認められる反応であり、トリオースリン酸イソメラーゼも共通しています。グリセルアルデヒド-3-リン酸はその後解糖系に利用され、ATP の産生に利用されます。
脂肪酸の細胞内への取り込みとミトコンドリアへの輸送
脂肪酸が各組織まで運搬されると細胞に取り込まれます。脂肪酸の取り込みには以下の二通りがあります。
- 脂肪酸輸送タンパク質による能動的な取り込み
- 脂肪酸の受動拡散による取り込み(flip-flop 拡散)
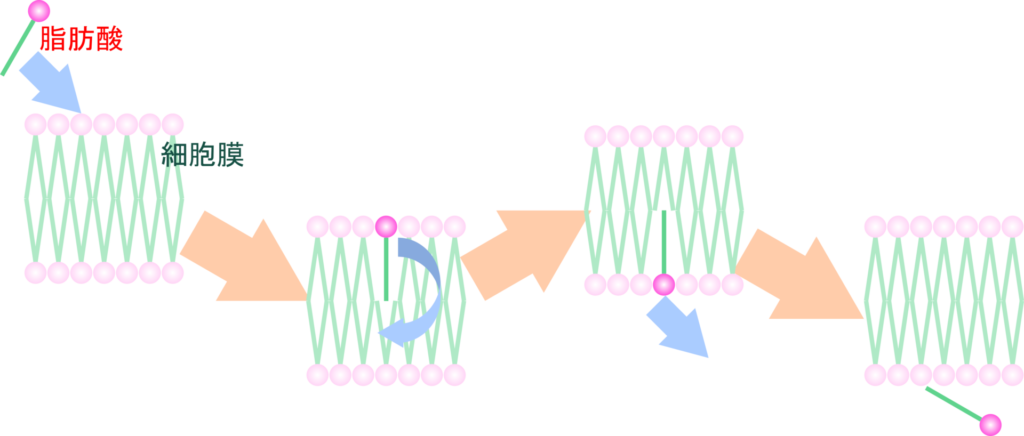
脂肪酸の受動拡散はフリップ・フロップ(flip-flop)と呼ばれる方式で細胞膜を超えて拡散します。脂肪酸が細胞膜に入ると反転するようにして膜の反対側に移行し、膜内へ拡散していきます(図3)。
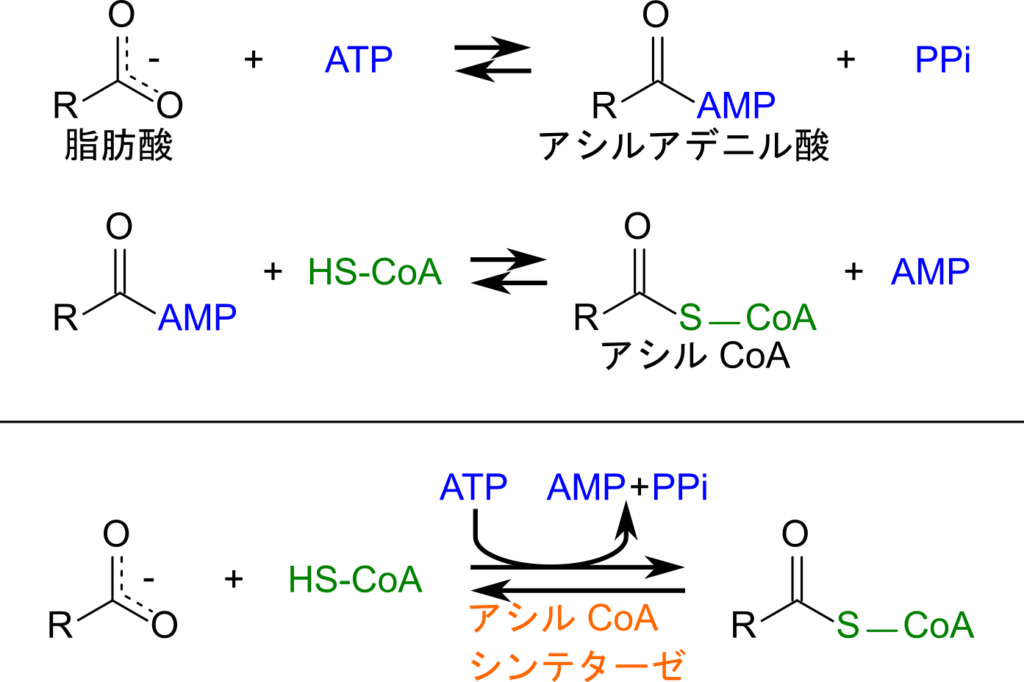
脂肪酸の酸化はミトコンドリアのマトリックスで行われますので、ミトコンドリア内に脂肪酸が取り込まれる必要があります。細胞膜を透過した脂肪酸は脂肪酸結合タンパク質と結合してミトコンドリアへ運搬します。ミトコンドリア外膜ではアシル CoA シンテターゼの作用により脂肪酸に CoA が付加されてアシル CoA となり、活性化されます。この反応では ATP を消費しますが、よくあるリン酸化ではなく AMP がアシル基に付加されアシルアデニル酸とピロリン酸(PPi)が生成されます。ピロリン酸はピロフォスファターゼの作用により即座にリン酸基2分子へ分解され、さらにエネルギーを得ることができます。![]()
この過程によりこの反応では ATP 二分子分のエネルギーを得ることができるためこの反応を有利に進める原動力となります。一方で、アシルアデニル酸のカルボニル基が補酵素A(CoA)のチオール基から求核的に攻撃されて結合し、アシルCoA が生成し、AMP が遊離します。ここまでの反応をまとめると、脂肪酸と CoA、ATP からアシル CoA と AMP と ピロリン酸を得る反応となります。
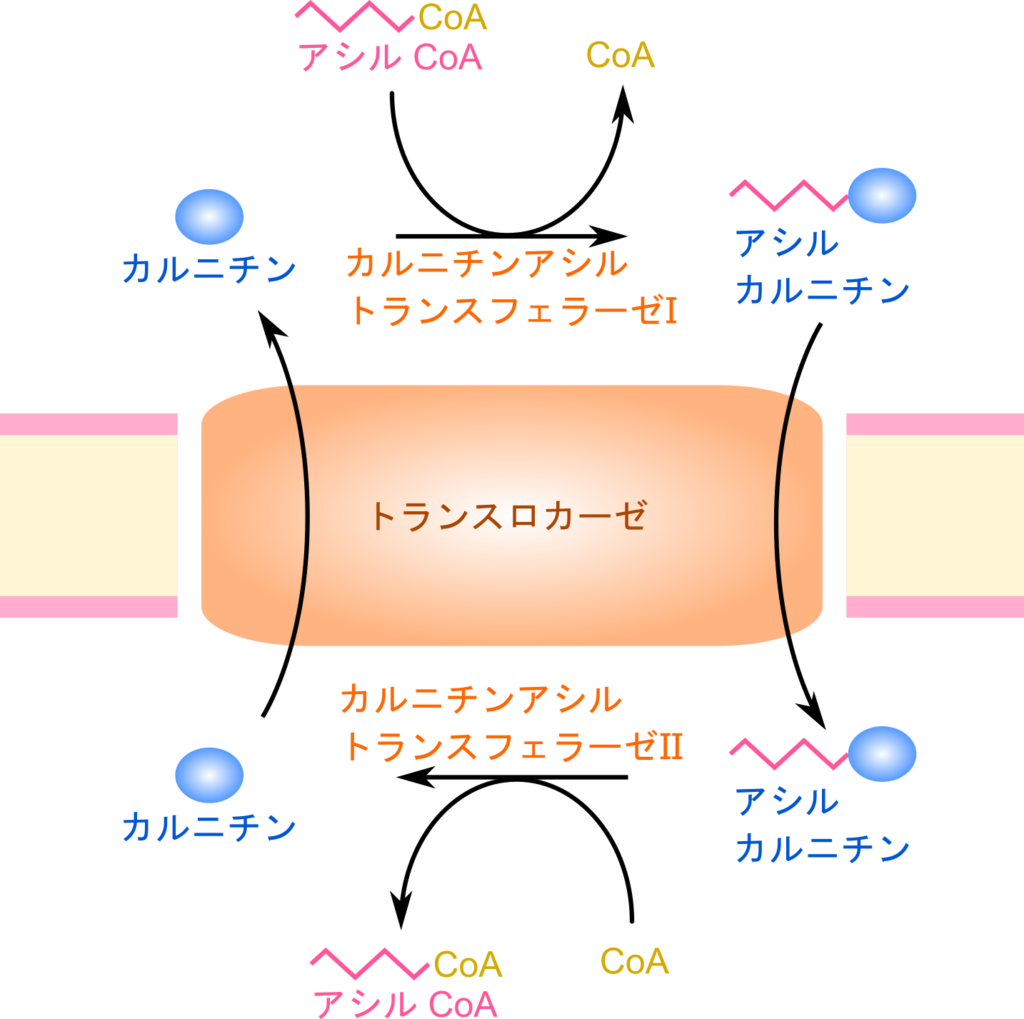
活性化を受けたアシル CoA はミトコンドリア外膜を超えてマトリックスへ輸送されます。短鎖~中鎖脂肪酸はミトコンドリア外膜を透過できるのでそのまま透過しますが、長鎖脂肪酸は透過できないので輸送に工夫が必要になります。長鎖脂肪酸の輸送にはカルニチンとトランスロカーゼが関与します。以下に長鎖脂肪酸の輸送メカニズムを見ていきましょう。
カルニチンはアシル CoA の CoA と交換されてアシルカルニチンと CoA を生成します。この反応はミトコンドリア外膜に結合しているカルニチンアシルトランスフェラーゼⅠの作用により進行します。
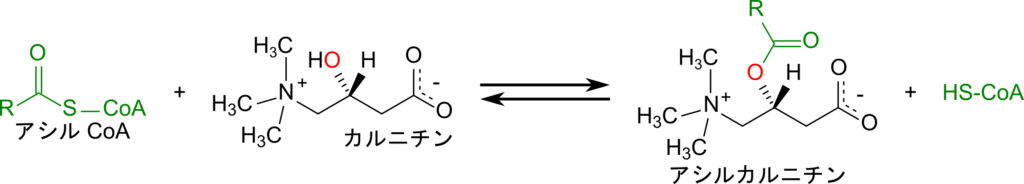
生成されたアシルカルニチンはトランスロカーゼの作用によりミトコンドリアマトリックスへ輸送されますが、この輸送はカルニチンと共役しています(カルニチンと交換する形でアシルカルニチンがマトリックス側へ、カルニチンが細胞質側へ輸送されます)。マトリックス側に輸送されたアシルカルニチンはカルニチンアシルトランスフェラーゼⅡの作用により脂肪酸は CoA と縮合してアシル CoA となり、カルニチンが遊離します。こうして遊離したカルニチンはアシルカルニチンと交換で細胞質側へ輸送され、アシル CoA との反応に利用されます。
こうしてミトコンドリアのマトリックスへ取り込まれた脂肪酸は β 酸化経路を経て NADH や FADH2、アセチル CoA などを産生し、エネルギー代謝でこれらの分子が利用されることで ATP を産生します。
練習問題
脂肪滴から脂肪酸の遊離に関する記述で正しいものを選べ。
GPCR の作用機序について正しい記述を選べ。
ミトコンドリアのマトリックスへの脂肪酸輸送に関する記述で正しいものを選べ。
今回の記事では、脂肪細胞に蓄積された脂肪が、どのようにして脂肪滴から解放され、最終的に酸化の場である各細胞のミトコンドリアまで運ばれていくのか、その精緻な輸送機構に焦点を当てて解説してきました。
この一連の過程には、脂肪酸という水に溶けにくく扱いづらい分子を、効率的かつ安全に運搬するための巧妙な仕組みが張り巡らされており、生命システムの精妙さを改めて実感させられます。さらに、この記事でも触れたように、脂肪酸の放出に関与するGPCR(Gタンパク質共役型受容体)のような分子機構は、ホルモン応答に限らず、視覚や嗅覚、神経伝達など多岐にわたる生命現象の根幹を支えており、他の生理学的分野でも応用される重要な知識です。
脂肪酸の輸送と代謝の理解は、エネルギー代謝の全体像を把握するうえで不可欠であり、また生化学や分子生物学を学ぶ上でも応用範囲の広いテーマです。
本記事が、皆さんのより深い理解への助けとなり、今後の学習や探究に繋がる契機となれば幸いです。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 190-207
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.440-476
- Oberer, M., Boeszoermenyi, A., Nagy, H. M., & Zechner, R. (2011). Recent insights into the structure and function of comparative gene identification-58. Current Opinion in Lipidology, 22(3), 149–158. https://doi.org/10.1097/MOL.0b013e328346230e
- Ross, E. M. (2014). G Protein-coupled receptors. Cellular Logistics, 4(2), e29391. https://doi.org/10.4161/cl.29391
- Ma, Y., Nenkov, M., Chen, Y., Press, A. T., Kaemmerer, E., & Gassler, N. (2021). Fatty acid metabolism and acyl-CoA synthetases in the liver-gut axis. World Journal of Hepatology, 13(11), 1512–1533. https://doi.org/10.4254/wjh.v13.i11.1512
- Schönfeld, P., & Wojtczak, L. (2016). Short- and medium-chain fatty acids in energy metabolism: The cellular perspective. In Journal of Lipid Research (Vol. 57, Issue 6, pp. 943–954). American Society for Biochemistry and Molecular Biology Inc. https://doi.org/10.1194/jlr.R067629