アミノ酸は私たちの生命活動を支える大切な分子ですが、その分解経路は驚くほど多様です。特に芳香族アミノ酸は、複雑な環構造を持つがゆえに、その代謝経路は複雑で、特徴的であるだけでなく、他のアミノ酸とも深く関連しています。本記事では、芳香族アミノ酸や関連アミノ酸の異化経路をわかりやすく詳説します。
Contents
芳香族アミノ酸の異化経路の概要
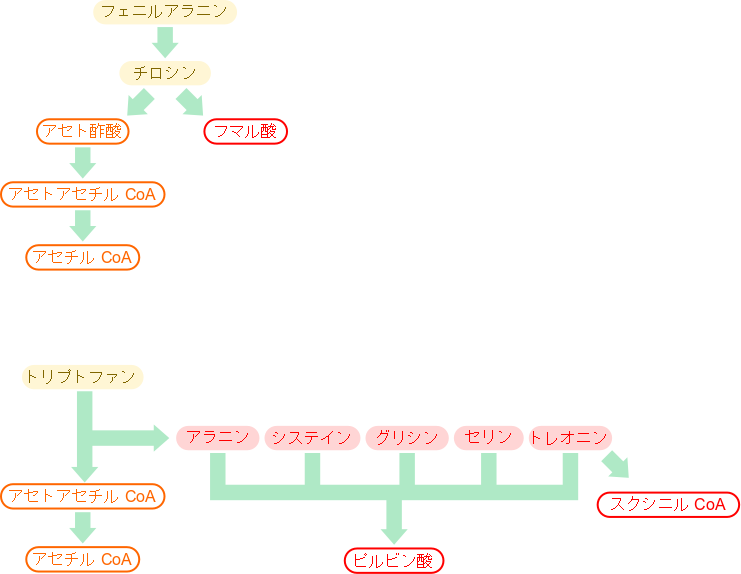
芳香族アミノ酸の異化を考える場合、フェニルアラニン、チロシンの異化経路とトリプトファンの異化経路に分けて考えましょう。
フェニルアラニンは水酸基を導入されてチロシンに変換されます。その後脱アミノ化を経て開環し、二つに開裂してフマル酸とアセト酢酸を生成します。アセト酢酸はアセトアセチル CoA 、さらにはアセチル CoA に変換されます。フマル酸は TCA 回路を経てオキサロ酢酸に変換されると糖新生に利用されます。このことからフェニルアラニンとチロシンは糖原生を有します。一方でアセト酢酸のようなケトン体やアセトアセチル CoA やアセチル CoA のようなケトン体を生成する物質を産生することから、ケト原生も有しています。したがって、フェニルアラニンとチロシンはいずれも糖原生・ケト原生の両方を持つアミノ酸です(図1)。
トリプトファンは側鎖のインドール環(六員環+五員環の構造)の五員環部分が開環して、主鎖部分が遊離するとアラニンを与えます。一方で、残る部分がさらに開環していくつかの反応を経るとアセトアセチルCoA を生成します。一方で、アラニンは脱アミノ化されてピルビン酸を生成します。ピルビン酸は糖新生に利用されるので、トリプトファンは糖原生を有しているアミノ酸です。また、アセトアセチル CoA はアセチル CoA に変換されますが、アセチル CoA は各種ケトン体の原料となりますので、トリプトファンはケト原生も有します。一方で、アラニン同様システイン、グリシン、セリンも分解されるとピルビン酸を与えるアミノ酸です。ただし、これらのアミノ酸からアセトアセチル CoA は生成されません。このことから、これらのアミノ酸は糖原生のみを有するアミノ酸です。トレオニンについてはヒトではスクシニル CoA を産生するので糖原生を示すアミノ酸となりますが(図1)、他の生物種ではピルビン酸とアセチル CoA を産生するのでケト原生と糖原生を示すアミノ酸に分類されます。この点についてはのちに詳述します。
芳香族アミノ酸の異化経路の詳細
フェニルアラニン・チロシンの異化経路の詳細
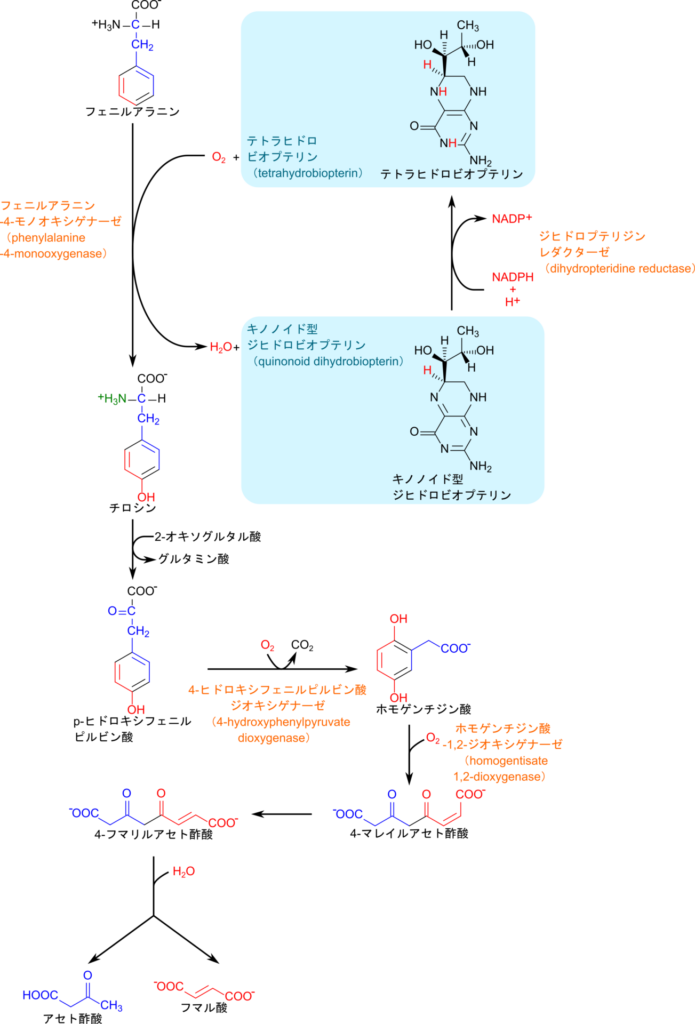
フェニルアラニンの異化の第一段階ではヒドロキシ化(水酸基付加)されてチロシンに変換されます。この反応は酸素分子が消費されますが、二つある酸素原子の内、ヒドロキシ化に利用されるのは一つだけで、もう一方は水素化されて水分子に変換されます。このためこの反応を触媒する酵素はフェニルアラニン-4-モノオキシゲナーゼ(一原子酸素添加酵素;monooxygenase)と呼ばれています。この反応はテトラヒドロビオプテリン(tetrahydrobiopterin)が還元剤として機能しています。テトラヒドロビオプテリンはビオプテリンから誘導される誘導体で、フェニルアラニンのヒドロキシ化に伴ってキノノイド型ジヒドロビオプテリンに変換されます。キノノイド型は酸化型でもあり、NADPH によって還元されることでテトラヒドロビオプテリンが再生されます。この反応はジヒドロプテリジンレダクターゼによって触媒されます。なお、ビオプテリンは体内で合成されるためビタミン(ビタミンは、生命の維持に必要不可欠な微量栄養素であり、体内で十分に合成できないため、必須栄養素として外部から摂取する必要があるものを言います)ではありませんの注意してください(図2)。
生成されたチロシンは脱アミノ化されたのち、酸素原子を取り込むとともに炭酸を遊離します。この反応では酸素がカルボニル基に導入されてカルボキシル基に変換される一方で、ベンゼン環にも酸素が取り込まれて水酸基が付与されます。この時、カルボキシル基を含む置換基は隣の炭素に転位されていることに注意してください。このようにして、ホモゲンチジン酸が生成されます。この反応では二つの酸素原子の内、両方が分子に取り込まれるのでジオキシゲナーゼ(dioxygenase)と呼ばれています。続いて、再び酸素が取り込まれることで芳香環が開裂して 4-マレイルアセト酢酸が生成されます。続いてこの分子が異性化されて、 4-フマリルアセト酢酸に変換されます。この異性化が行われているため、4-フマリルアセト酢酸は加水分解を受けるとフマル酸とアセト酢酸を産生できます。生成されたフマル酸は TCA 回路に合流してその後の反応に利用されます(図2)。
トリプトファンの異化経路
トリプトファンの異化経路ではまず、インドール環の五員環部分が酸素付加を受けて開環します。その後、水が付加してホルミル基が脱離してギ酸が生成します。その後、酸素分子が使用されて一つの酸素原子が水酸基として導入され、もう一方は水として遊離されます。このようにして得られた 3-ヒドロキシキヌレニンは主鎖部分にアラニンの構造をもっています。3-ヒドロキシキヌレニンに水が付加してアラニン部分が遊離するとカルボニル基はカルボキシル基に変換され、3-ヒドロキシアントラニル酸が生成されます。さらに、酸素が結合すると残った六員環も開環して脱炭酸・酸化などの工程を経て、最終的にアセト酢酸を生成します。一方で、アラニンは脱アミノ化されてピルビン酸に変換されます(図3)。

上述の通り、トリプトファンの異化経路はアラニンの異化経路も内包します。アラニンは異化の結果ピルビン酸を生成しますが、他にもピルビン酸を生成するアミノ酸は存在します。セリン、システイン、トレオニンはアラニンと同様にピルビン酸を生成するアミノ酸です。以下に、これらのアミノ酸の異化経路についてみていきましょう。
グリシンの異化経路
グリシンは 5,10-メチレンテトラヒドロ葉酸からメチレン基を受け取ると同時に水が付加されて水酸基を受け取り、セリンに変換されます。生成されたセリンは次の項目に示すようにピルビン酸に分解されます。ところで、5,10-メチレンテトラヒドロ葉酸から受け取るメチレン基はもう一分子のグリシンからテトラヒドロ葉酸が受け取ったものが使用されます。メチレン基を渡したグリシンは分解されてアンモニアと炭酸に分解されます(図3)。
セリンの異化経路
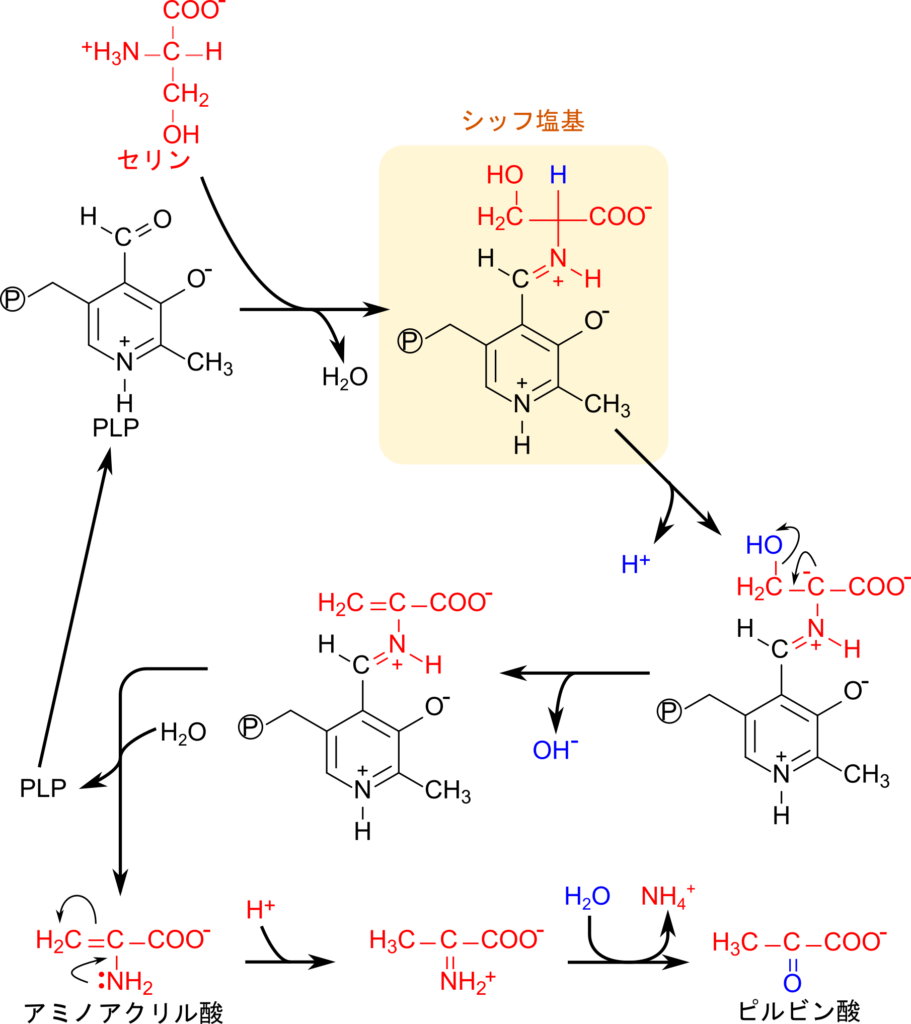
セリンの異化経路はピリドキサールリン酸(PLP)が関与して行われます。まずセリンの窒素原子が PLP のホルミル基を攻撃して結合し、シッフ塩基が形成されます。その後、セリン部分の α 炭素からプロトンが脱離しますが、この時 α 炭素はカルボアニオンとなります。その後、水酸基が脱離し、水が付加することで基質が脱離します。その結果、アミノアクリル酸が生成され、その後、アミノ基が脱離して最終的にピルビン酸が生成されます(図4)。以前の記事で、アミノ基転位反応を紹介しました(詳細はこちら)。この反応でもアミノ基転位反応に PLP が関与していましたが、PLPがケチミンを経由してα-ケト酸を生成しましたが、セリンの異化経路ではアミノアクリル酸を中間体としたアンモニアの遊離が進行します。したがって、セリンからアミノアクリル酸を経て進む経路はアミノ基転位反応とは異なる点に注意してください。
トレオニンの異化経路
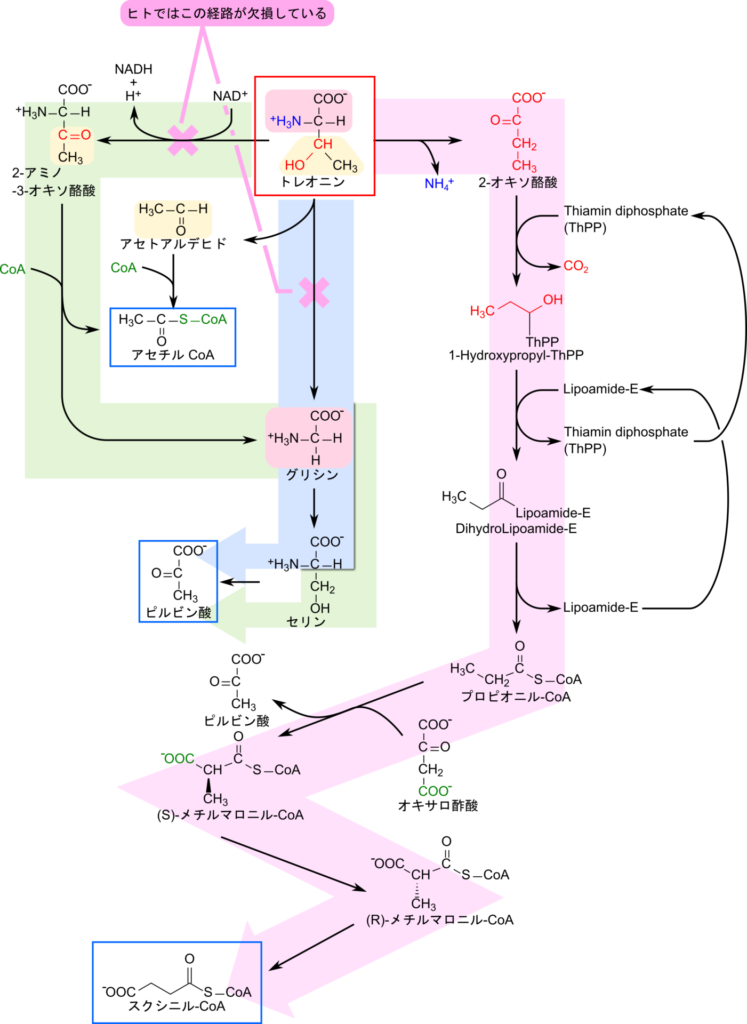
トレオニンの異化経路は少し複雑です。トレオニンの異化経路は三つが知られています。一つは 2-アミノ-3-オキソ酪酸を経由してグリシンを生成する経路です(図5の緑矢印の経路)。二つ目はトレオニンからグリシンを生成する経路です(図5の青矢印の経路)。三つめは 2-オキソ酪酸を経由してスクシニル CoA を生成する経路です(図5の赤矢印の経路)。この三つの経路の内、グリシンを経由する2経路についてはアセチル CoA とピルビン酸を生成するため、これらの経路ではトレオニンはケト原生と糖原生の両方を示します。ところが、2-オキソ酪酸を経由する経路ではスクシニル CoA を生成するため、トレオニンは糖原生のみを示すことになります。
さて、トレオニンが糖原生を示すか、ケト原生と糖原生の両方を示すかについて考察します。このポイントは混乱しやすいポイントですので注意が必要です。トレオニンから 2-アミノ-3-オキソ酪酸を生成する反応は L-トレオニン-3-デヒドロゲナーゼ(L-threonine 3-dehydrogenase)によって触媒されています。一方で、トレオニンからグリシンを生成する反応は トレオニンアルドラーゼ(L-threonine aldolase)によって触媒されています。これらの酵素をコードする遺伝子はヒトではいずれも偽遺伝子(pseudogene)となっており、活性をもたなくなっています。偽遺伝子というのは突然変異によってストップコドンが途中に入り込んだり、塩基が挿入されたことにより3塩基のフレームがズレてしまったり(フレームシフト)してしまった結果、機能を喪失してしまった遺伝子のことを言います。その結果、ヒトにおいてはアセチル CoA を生成する2経路が欠失してしまう結果になっています。そこで、ヒトでは 2-オキソ酪酸を経由する経路がトレオニンの主要な異化経路として利用されています。このことから、ヒトに限定した場合、トレオニンは実質的に糖原生のみを示すことになります。例えば、マウスや微生物、植物などの生物ではトレオニンデヒドロゲナーゼを持っていますので、糖原生とケト原生の両方を示すことになります。
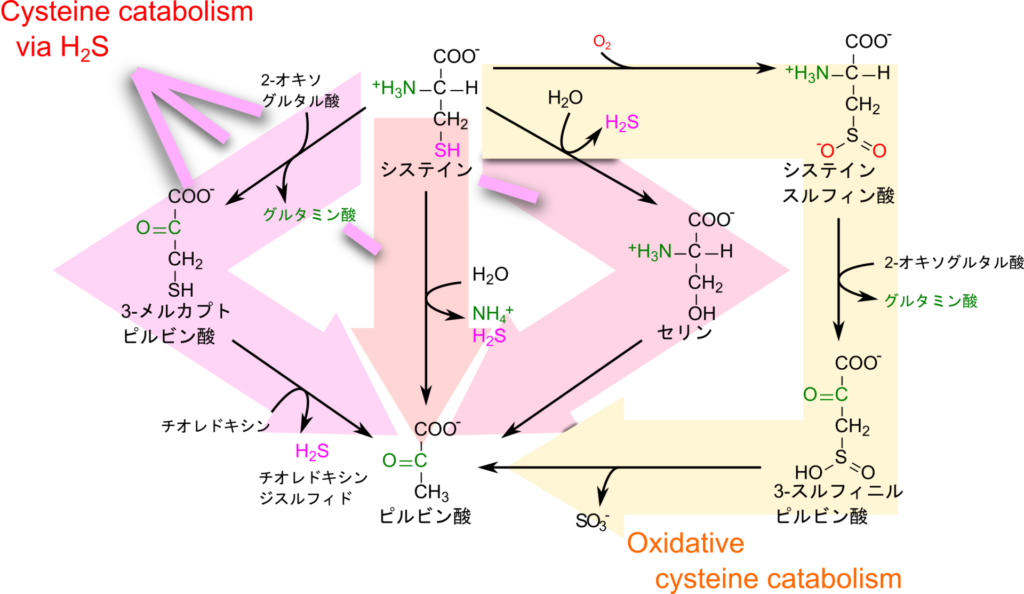
システインの異化経路
システインの異化経路には複数の経路が存在しています。これらの経路は大きく分けて以下の二つに分類ができます(図6)。
- Oxidative Cysteine Catabolism(酸化的なシステイン分解経路)
- システインの酸化に始まり、亜硫酸とピルビン酸が生成されます。
- 硫化水素産生を介した経路(Cysteine Catabolism via H2S)
- 硫化水素とピルビン酸を産生する経路です。この経路はさらに以下の三つの経路が知られています。
- 直接ピルビン酸を生成する経路
- アミノ基転位を経て 3-メルカプトピルビン酸を経由してピルビン酸に至る経路
- 硫化水素を遊離させてセリンに変換されたのちにピルビン酸を生成する経路
- 硫化水素とピルビン酸を産生する経路です。この経路はさらに以下の三つの経路が知られています。
こうして産生された硫化水素や亜硫酸塩はシアン化物を無毒化するために利用されることがあります。シアン化物は植物など環境中に存在しますが、毒性が高く体内で無毒化される必要があります。シアン化物の無毒化にはローダナーゼ(Rhodanese)により触媒されます。硫化水素と亜硫酸塩は酵素反応を介してチオ硫酸塩に変換されます。![]()
このようにして産生されたチオ硫酸塩はローダナーゼによるシアン化物の無毒化に利用されます。![]()
このようにしてシアン化物はチオシアン化物に変換されて無毒化されます。
練習問題
芳香族アミノ酸と関連アミノ酸の異化経路は、単なる分解ではなく、私たちの体を支える多面的な代謝ネットワークの一部です。さらに、関連するアミノ酸の異化経路にも複雑で混乱しやすいポイントがいくつかあります。例えば、セリンの異化経路はアミノ基転位と似ていますが、異なるメカニズムによるものです。また、トレオニンの異化ではヒトと他の生物で経路が大きく異なるなど、一見単純に見えるアミノ酸でもその異化経路は意外に奥が深いのです。さらに、システインの異化産物がシアン化物の無毒化に寄与するように、アミノ酸の異化にはさまざまな機能的側面があります。この記事では、単なる分解経路の説明にとどまらず、これらの複雑な側面もわかりやすく解説しています。これらの経路を深く理解することで、生命の巧妙な仕組みへの理解がより一層深まるでしょう。ぜひ何度も読み返し、学びを深めてください!
参考文献
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.633-662, pp.597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.477-513
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 208-223
- KEGG PATHWAY DATABASE. 2025-03-03. https://www.genome.jp/kegg/pathway.html
- Raspail, C., Graindorge, M., Moreau, Y., Crouzy, S., Lefèbvre, B., Robin, A. Y., Dumas, R., & Matringe, M. (2011). 4-Hydroxyphenylpyruvate Dioxygenase Catalysis. Journal of Biological Chemistry, 286(29), 26061–26070. https://doi.org/10.1074/jbc.M111.227595 (tryptophan catabolism)
- Edgar, A. J. (2005). Mice have a transcribed L-threonine aldolase/GLY1 gene, but the human GLY1 gene is a non-processed pseudogene. BMC Genomics, 6. https://doi.org/10.1186/1471-2164-6-32 (threonine catabolism)
- Edgar, A. J. (2002). The human L-threonine 3-dehydrogenase gene is an expressed pseudogene. BMC Genetics, 3(1), 18. https://doi.org/10.1186/1471-2156-3-18 (threonine catabolism)
- Guenter Schwarz, C., Kohl, J. B., Mellis, A.-T., & Schwarz, G. (2019). Homeostatic impact of sulfite and hydrogen sulfide on cysteine catabolism LINKED ARTICLES. British Journal of Pharmacology, 176, 554. https://doi.org/10.1111/bph.v176.4/issuetoc (cysteine catabolism)
- Jaszczak, E., Polkowska, Ż., Narkowicz, S., & Namieśnik, J. (2017). Cyanides in the environment—analysis—problems and challenges. Environmental Science and Pollution Research, 24(19), 15929–15948. https://doi.org/10.1007/s11356-017-9081-7 (cysteine catabolism)