分岐鎖アミノ酸(バリン・ロイシン・イソロイシン)の異化経路は、糖新生やケトン体生成と密接に関わる重要な代謝ルートです。さらに、メチオニンやリシンの異化ともつながりがあり、深い生理的な意義を持っています。この記事では、それぞれの経路を図解とともにわかりやすく整理し、反応機構や重要な中間体のポイントも丁寧に解説します。
Contents
分岐鎖アミノ酸とリシン、メチオニンの異化経路の概要
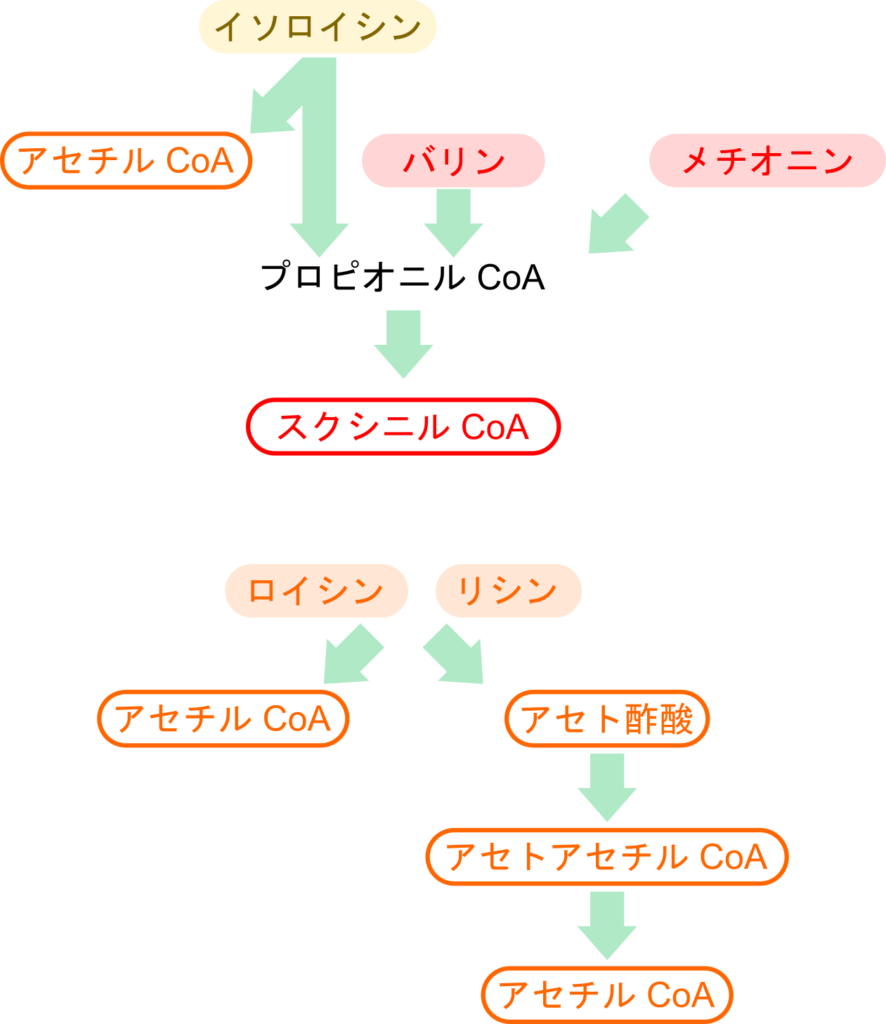
分岐鎖アミノ酸(BCAA;Branched Chain Amino Acid)とは炭素骨格の一部が分岐した構造を持つものを言います。分岐鎖アミノ酸にはバリン、イソロイシン、ロイシンが含まれます。これらのアミノ酸の異化経路は互いによく似た経路をたどりますので、関連付けながら理解するとわかりやすいと思います。
イソロイシンの異化経路ではアセチル CoA とプロピオニル CoA を生成します。一方で、バリンの異化経路でもプロピオニル CoA を生成します。プロピオニル CoA はさらにいくつかの異性化を受けてスクシニル CoA に変換されます。
ところで、アセチル CoA はケトン体の原料となりますので、アセチル CoA を生成するアミノ酸はケト原生を持つことになります。一方で、スクシニル CoA は TCA 回路に合流したのち、オキサロ酢酸に変換されますが、オキサロ酢酸は糖新生にも利用される物質ですので、スクシニル CoA を生成するアミノ酸は糖原生を有することになります。
イソロイシンはアセチル CoA とスクシニル CoA を生成することからケト原生と糖原生の両方を示し、バリンはスクシニル CoA を生成しますので、糖原生を示します。また、メチオニンも異化産物としてスクシニル CoA を生成します。このことから、メチオニンは糖原生を有します(図1)。
ロイシンの異化経路ではアセチル CoA とアセト酢酸を産生します。一方でリシンもアセチル CoA とアセト酢酸を異化産物とするアミノ酸です。アセチル CoA は前述のとおりケトン体の前駆体となり、アセト酢酸はケトン体です。したがって、ロイシンとリシンはケト原生を示すアミノ酸となります(図1)。
分岐鎖アミノ酸の異化経路
分岐鎖アミノ酸の異化によるプロピオニル CoA の生成
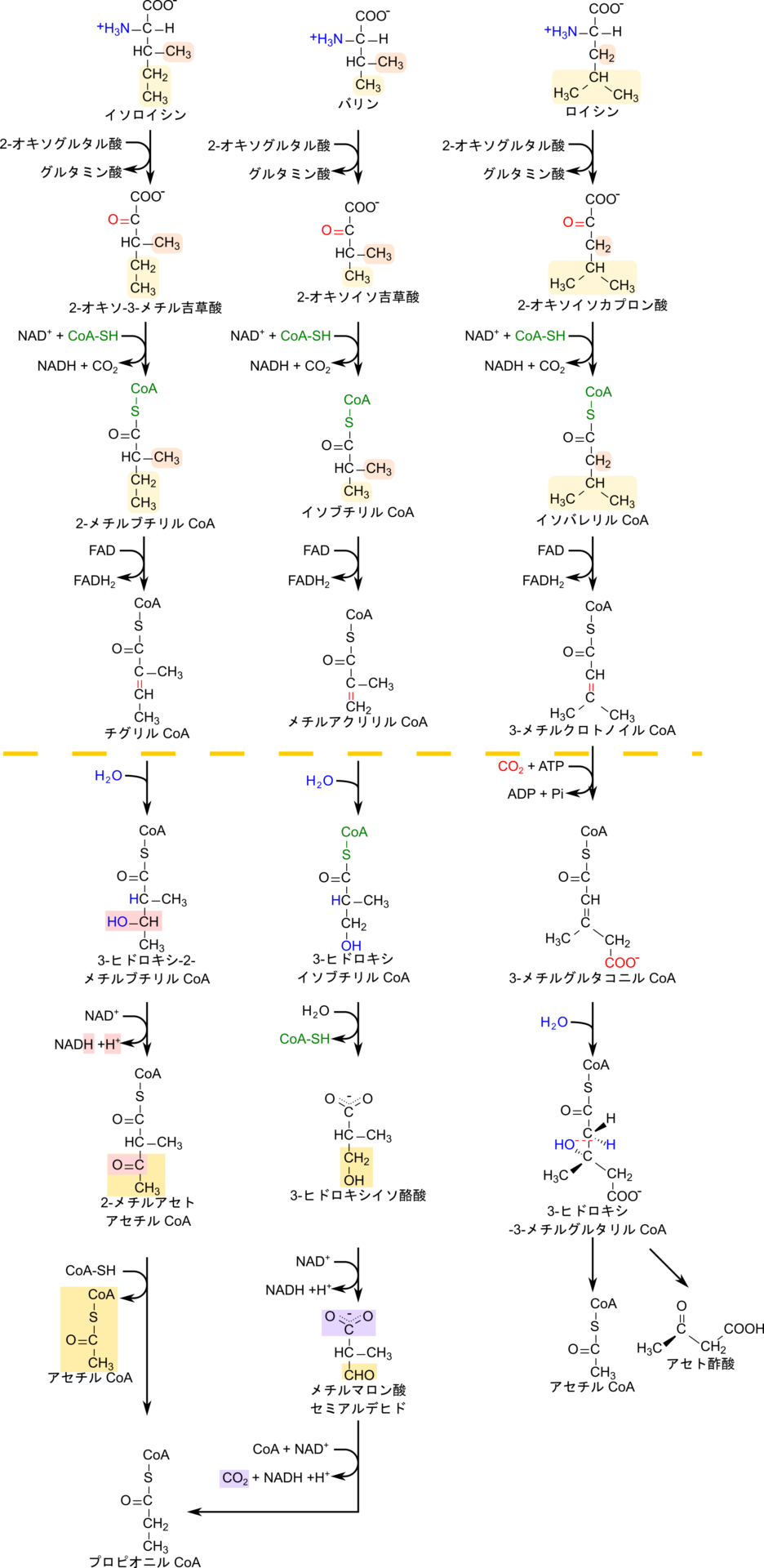
分岐鎖アミノ酸の異化経路は途中まで共通した経路をたどります。これらの共通した経路に注目するため、中間体であるプロピオニル CoA の生成までの経路について注目します。これらのアミノ酸は最初にアミノ基転位反応を経てアミノ基を 2-オキソグルタル酸に渡し、それぞれに対応した 2-オキソ酸を生成します。次に、CoA が導入されるとともに、カルボキシル基が炭酸として遊離します。この反応は酸化的脱炭酸によって進行します(「酸化的脱炭酸によるアシル CoA の産生」で詳述します)。次に FAD を利用して脱水素化されて分子内に二重結合が形成されます。この二重結合はのちに水付加の足場となります。ここまでは三つのアミノ酸で共通した経路となり、次の段階からそれぞれのアミノ酸で異なる運命をたどります。
イソロイシンの異化経路では導入された二重結合に水が付加することで水酸基が導入され、NAD+ を利用した酸化を受けることで、導入された水酸基がカルボニル基(-CO-)に変換されます。その結果、末端にアセチル基が生成されます。このカルボニル基をターゲットとして CoA の硫黄原子が求核的に攻撃して結合することでアセチル CoA が遊離して、残った部分がプロピオニル CoA になります。プロピオニル CoA 以降の経路についてはのちの項目(「プロピオニル CoA のスクシニル CoA への変換」)で解説します。
バリンの異化経路では導入された二重結合に水が付加することで水酸基が導入されたのちに CoA が遊離します。その後、NAD+ を利用した酸化を受けることで末端の水酸基がホルミル基(-CHO 基)に変換されます。さらに、CoA の硫黄原子がホルミル基の炭素原子を求核的に攻撃して結合し導入されるとともに、カルボキシル基が炭酸として遊離します。この時、NAD+ を利用した酸化を受けます。この反応の結果、プロピオニル CoA が生成されます。この反応ではチアミン二リン酸とリポアミドを必要とせず、α ケト酸に CoA を導入する段階とは異なるメカニズムで進行します。
ロイシンの異化経路では ATP を消費してカルボキシル化されてカルボキシル基が末端に導入されます。その後、C=C の二重結合に水が付加することで水酸基が導入されます。さらに、ちょうど水が付加した位置で分子が開裂し、アセチル CoA とアセト酢酸が生成されます。
酸化的脱炭酸によるアシル CoA の産生
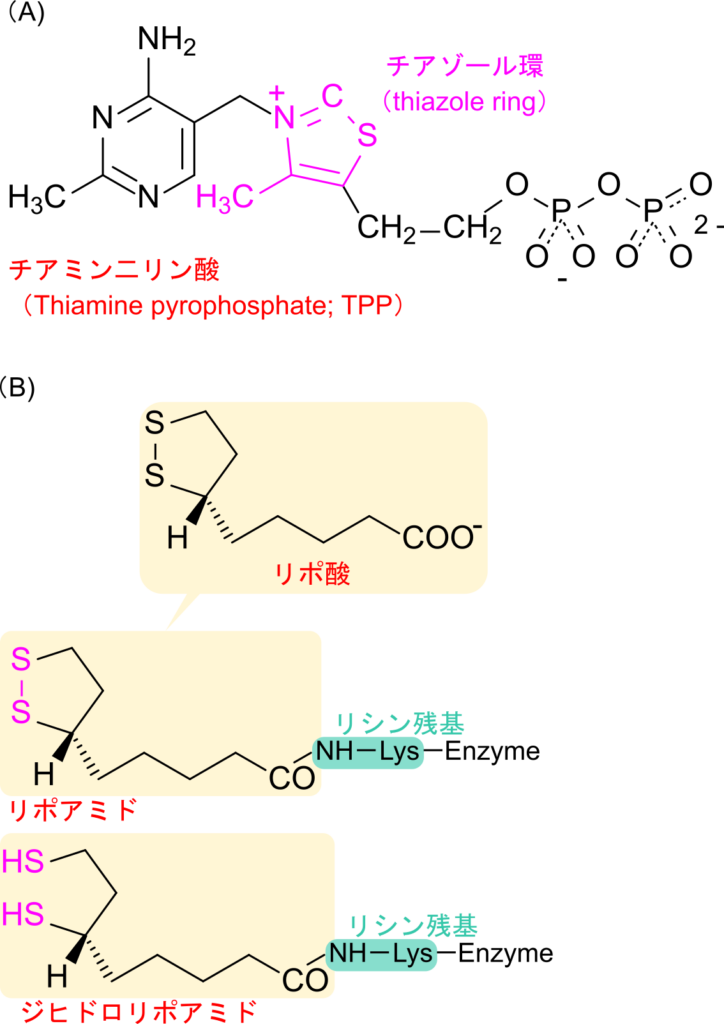
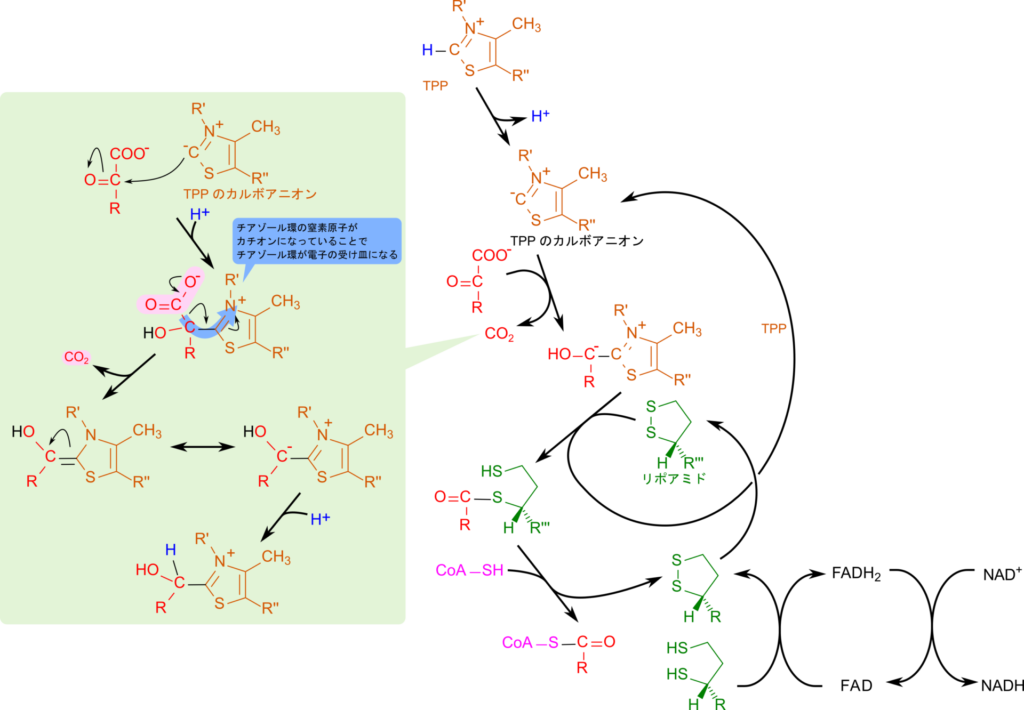
分岐鎖アミノ酸の異化経路の内、二段階目の反応はチアミン二リン酸とリポアミド、NAD+、CoA、FAD が協調的に作用して行われます。なお、チアミン二リン酸(Thiamine pyrophosphate; TPP)とリポアミドの構造を図3に示します。この反応はピルビン酸からアセチル CoA が生成する反応と同様のメカニズムによって起こる反応で、酸化的脱炭酸(oxidative decarboxylation)と呼ばれる重要な反応ですので、詳細について確認していきましょう。
TPP はプロトンを失うことでカルボアニオンに変換されます。この炭素が α ケト酸のカルボニル基を攻撃して結合します。その後カルボキシル基が炭酸として遊離します。この時、チアゾール環の正電荷を帯びた窒素原子が電子の受け皿となることで炭酸の脱離が起こりやすくなります。その後、基質部分がリポアミドに引き渡されます。次に α ケト酸から導入されたアシル基が CoA に渡される一方で、リポアミドはジヒドロリポアミドとなって遊離します。ところで、この時点ではリポアミドは還元型であるジヒドロリポアミドとなっており、このままでは次の反応に利用できません。そこで、FAD を利用して酸化されることで、ジヒドロリポアミドは酸化型のリポアミドに変換されます。さらに、生成された FADH2 は NAD+ を利用して FAD に再生されます。反応の前後をまとめると以下のようになります。
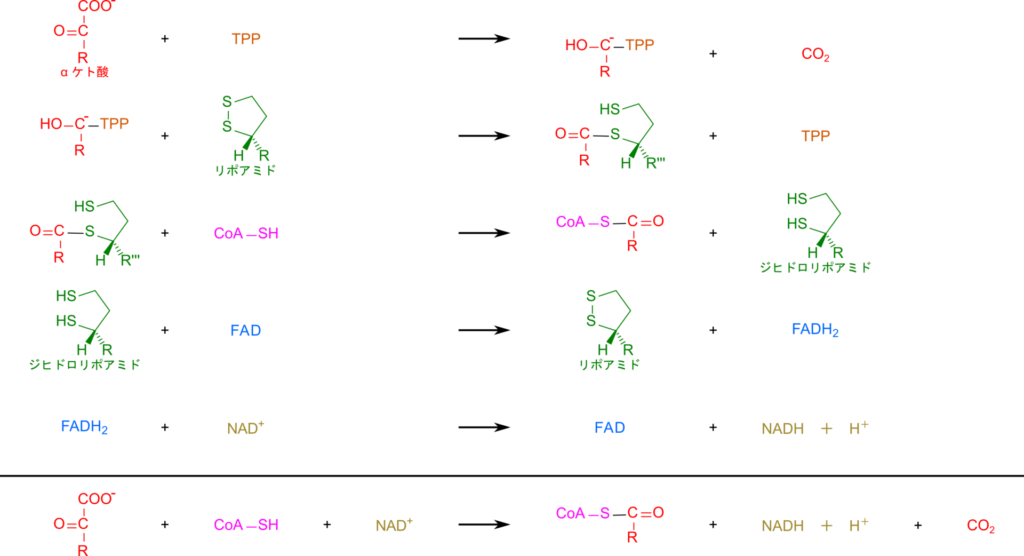
このことから、酸化的脱炭酸では α ケト酸と CoA、NAD+ を利用して、アシル CoAとNADH + H+、CO2 を生成します。
プロピオニル CoA のスクシニル CoA への変換
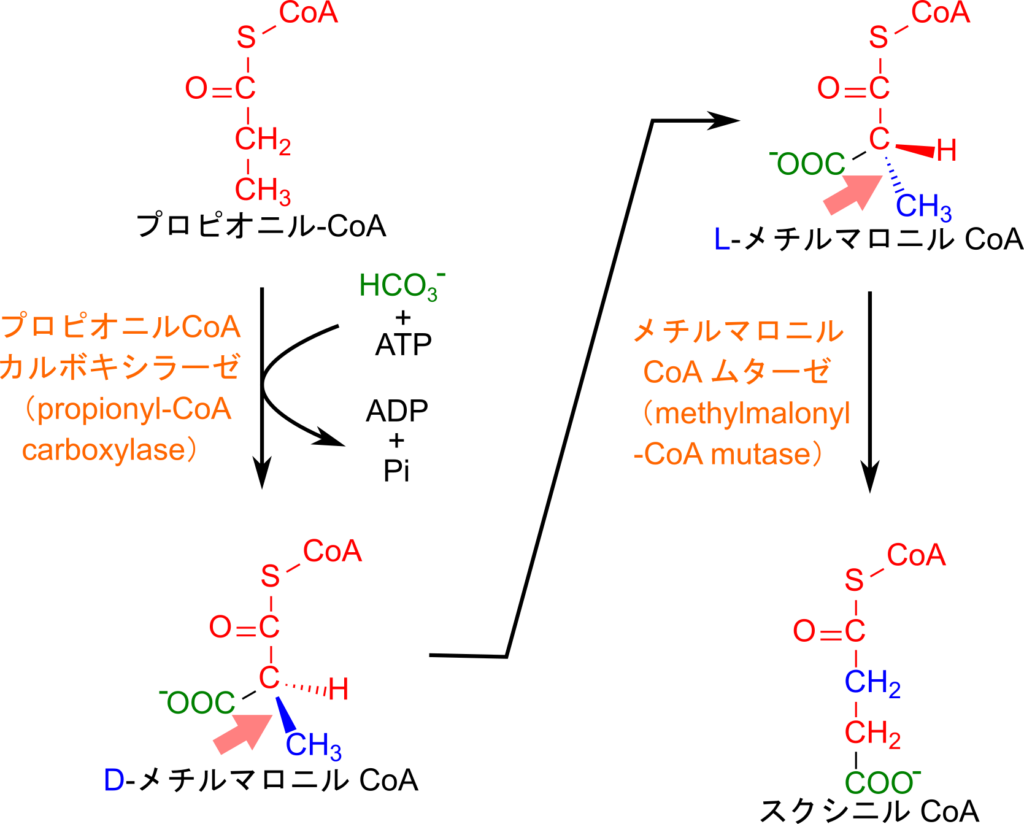
バリン、イソロイシン、さらに後述するメチオニンは異化中間体としてプロピオニル CoA を生成しますが、その後はどのような運命をたどるのでしょうか?
プロピオニル CoA は ATP を消費して炭酸をカルボキシル基として導入し、D-メチルマロニル CoA を生成します。その後、D 体が L 体に異性化されて L-メチルマロニル CoA が生成されます。この次のステップはスクシニル CoA の生成ですが、この反応はメチルマロニル CoA ムターゼにより触媒されます。この酵素は L 体のみを基質とすることが可能ですが、プロピオニル CoA から生成される分子は D 体ですので、異性化することで次の段階で酵素が基質として利用できるような形にしています。最後の段階では L-メチルマロニル CoA がスクシニル CoA に異性化されます(各置換基の順番に注意してみてください)。こうして産生されたスクシニル CoA は TCA 回路に合流し、最終的に糖新生にも利用されるようになります。
メチオニンの異化経路
メチオニンの異化経路はプロピオニル CoA を中間体として生成する
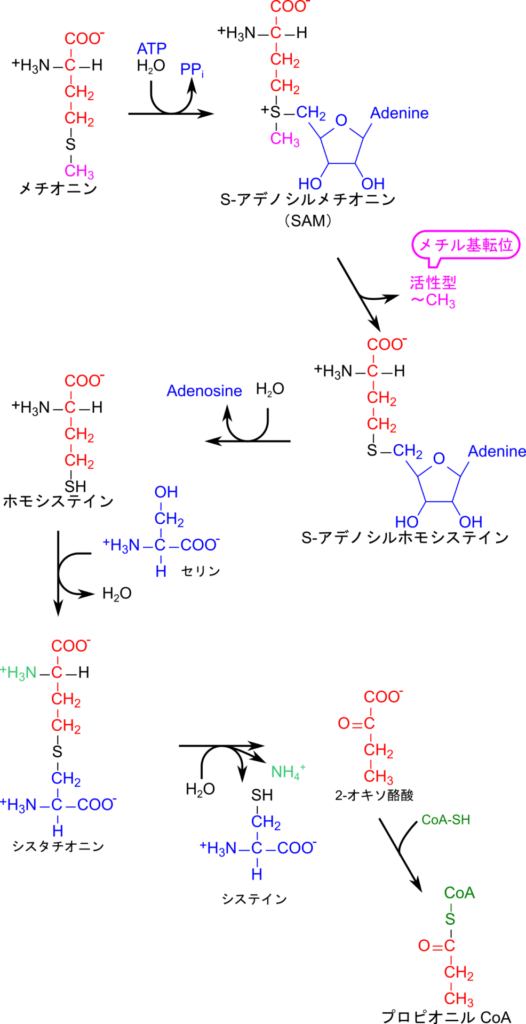
メチオニンの異化では硫黄原子を取り除かなければなりません。そこで、メチオニンはホモシステインを経由してセリンと反応し、最終的にシステインを生成することで、メチオニンの硫黄はシステインに渡されます。その一方で、自身は 2-オキソ酪酸へ変換され、CoA と縮合してプロピオニル CoA が生成されます(図4)。
メチオニンは ATP と反応して、アデノシンと結合し、S-アデノシルメチオニン(S-Adenosylmethionine;SAM)を生成します。この反応ではピロリン酸が遊離しますが、ピロリン酸は即座にリン酸へ分解されることでさらにエネルギーを放出します。このことから、SAM の生成では実質的に ATP 2 分子に相当するエネルギーを消費します。このことは SAM の生成を有利に進めることに貢献します。生成された SAM は強力なメチル基供与体として機能します。このため、SAM の硫黄原子に結合しているメチル基は容易に供与されて他分子のメチル化に利用されます。その後、水が付加することでホモシステインが遊離します。遊離したホモシステインはセリンと脱水縮合し、シスタチオニンを生成します。シスタチオニンは分解されることでシステインと 2-オキソ酪酸を生成します。この過程で、メチオニン由来のアミノ基は最終的にアンモニアとして遊離します。2-オキソ酪酸は上述の酸化的脱炭酸(「酸化的脱炭酸によるアシル CoA の産生」で詳述しています)によって、脱炭酸と CoA の導入が行われてプロピオニル CoA が生成されます。
この過程ではいくつかの重要な中間体が与えられます。メチオニンの異化経路では途中でシステインを生成します。このことからメチオニンの異化経路はシステインの生合成と深く関連した反応経路でもあります(こちらでも解説しています)。もう一つの重要な中間体は SAM です。この分子は強力なメチル基供与体で様々な分子にメチル基を付加して修飾する反応に利用される重要な分子です。
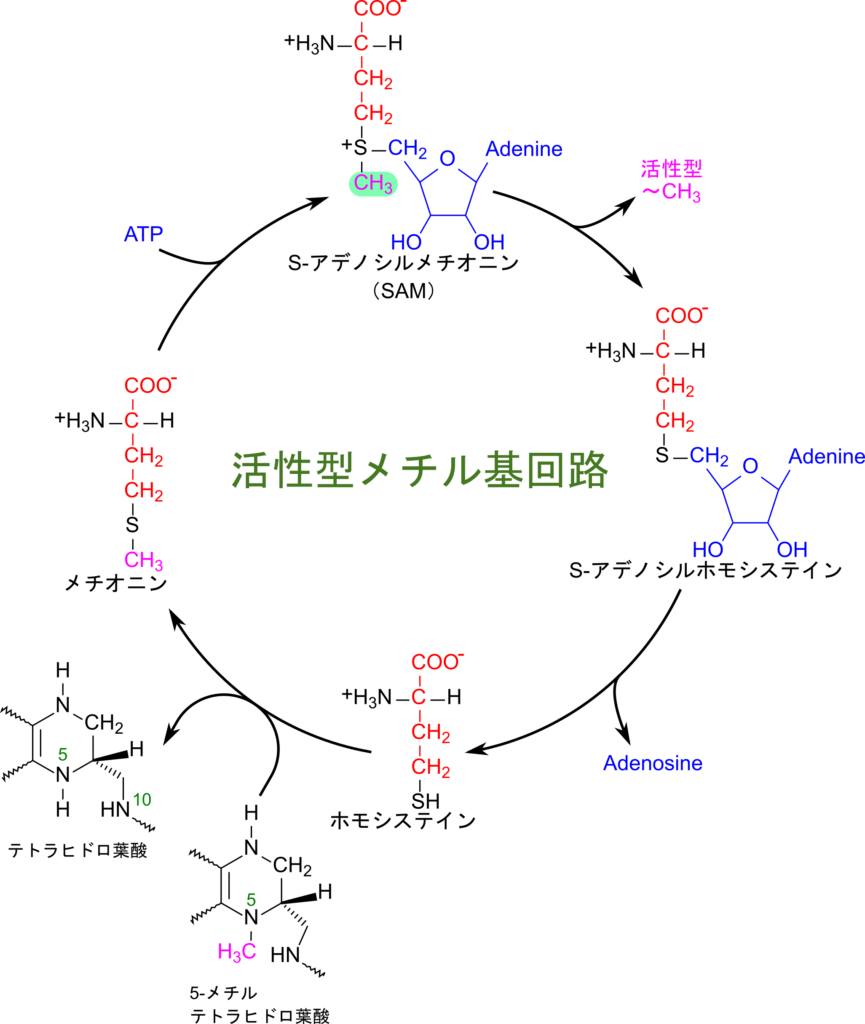
強力なメチル基供与体としての S-アデノシルメチオニン
メチオニンの異化中間体である S-アデノシルメチオニン(S–Adenosylmethionine;SAM)は強力なメチル基供与体として機能します(この点については以前の記事で詳細に解説していますのでそちらも参考にしてください)。SAM はメチオニンの異化に伴っても産生されますが、活性型メチル基回路(activated methyl cycle)によっても産生されます。この回路では、メチオニンが ATP と会合して SAM を生成し、メチル基を供与して S-アデノシルホモシステインに変換された後、アデノシンが脱離してホモシステインが生成されます。メチオニンの異化経路では、このホモシステインはセリンと縮合してシスタチオニンを経て代謝されますが、活性型メチル基回路ではホモシステインが 5-メチルテトラヒドロ葉酸からメチル基を供給され、メチオニンに変換されて回路が完成します。
SAM は硫黄が正電荷を持ち、隣接するメチル基の電子を引き込むためメチル基が求核攻撃を受けやすくなっているので、反応性が非常に高くなります。その結果、メチル基が転位されやすくなっています。
SAM は DNA や RNA などの塩基のメチル化、ホスファチジルエタノールアミンのメチル化によるホスファチジルコリンの生合成など、さまざまな生理的プロセスでメチル基供与体として活躍しています。
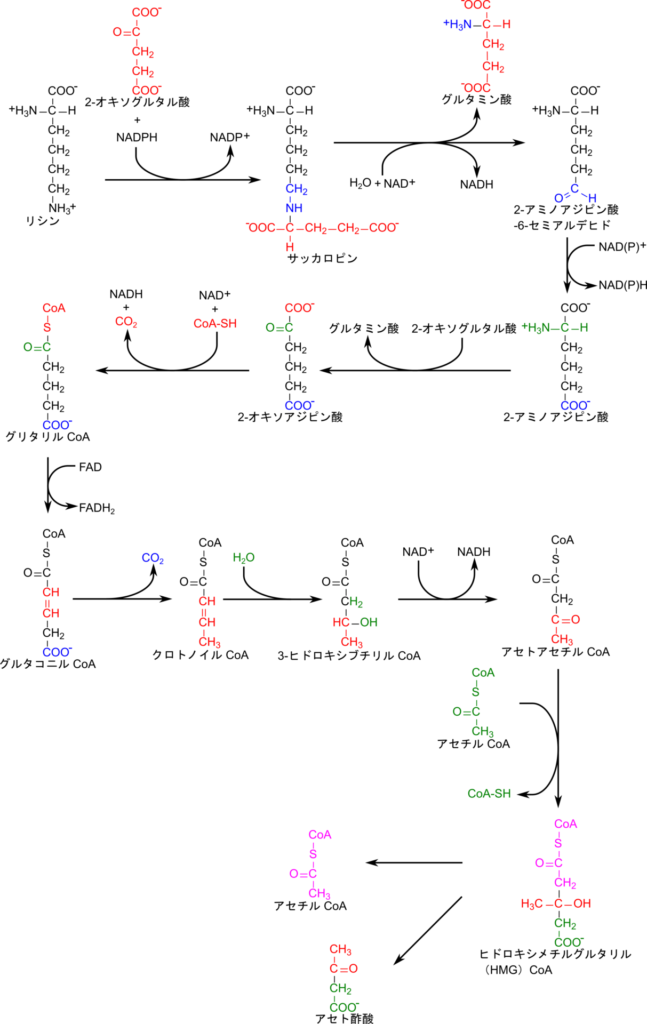
リシンの異化経路
リシンの異化経路では脱アミノ化を受け取ったのち、CoA の導入と炭酸の遊離、アセチル基の導入を経て最終的に開裂してアセチル CoA とアセト酢酸を産生します。
リシンの異化経路は、最初に脱アミノ化されます。リシンは 2-オキソグルタル酸のカルボニル基を側鎖のアミノ基が攻撃し結合してサッカロピンを与えます。サッカロピンからグルタミン酸が遊離すると側鎖の末端がホルミル基に変換されて 2-アミノアジピン酸-6-セミアルデヒドが生成します。その後ホルミル基が酸化されてカルボキシル基に変換されます。この過程はよくある PLP 依存的なアミノ基転位反応(詳細はこちら)とは異なる点に注意してください。その後 α アミノ基がアミノ基転位反応を経て 2-オキソグルタル酸へ渡されます。この反応は上述の反応と異なり、 PLP 依存的なアミノ基転位反応です。次に CoA の導入と炭酸の遊離が誘導されてグルタリル CoA が生成されます。この反応はCoA、チアミン二リン酸とリポアミド、FAD、NAD+ が協調的に働いて行われる反応で、「酸化的脱炭酸によるアシル CoA の産生」で解説した酸化的脱炭酸により進行します。その後、FAD を消費して二重結合が導入され、末端のカルボキシル基が炭酸として遊離します。さらに水が付加されたのち、酸化されることでカルボニル基が生成されます。次に、アセチル CoA からアセチル基を受け取りますが、この反応はクライゼン縮合(Claisen condensation)により行われます。この反応ではアセチル CoA のメチル基が脱プロトン化されることでエノールが形成され、脱プロトン化された炭素がカルボニル基を攻撃して結合することで縮合します。
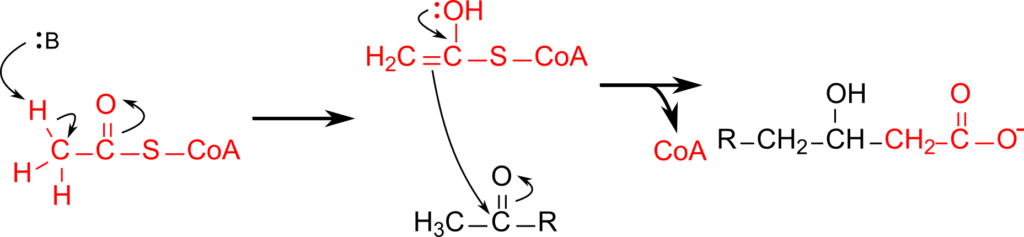
こうして生成されたヒドロキシメチルグルタリル CoA が開裂することでアセチル CoA とアセト酢酸を生成します(図5)。
練習問題
問1:図の1~6に当てはまるように分子を並べ替えよ

選択肢:
問2:酸化的脱炭酸に関する記述で正しいものを選べ:
問3:メチオニンから誘導される物質でメチル基供与体として利用される分子を選べ
問4:S-アデノシルメチオニンに関する記述で正しいものを選べ:
問5:リシンの異化経路に関する記述で正しいものを選べ:
問6:アセトアセチル CoA とアセチル CoA が縮合する反応に関する記述で正しいものを選べ:
今回は分岐鎖アミノ酸の異化経路を中心に、それらと同じ異化産物をもつアミノ酸(メチオニンやリシンなど)の代謝についても解説しました。分岐鎖アミノ酸は互いによく似た経路をたどるため、相互に関連づけながら学習することで、より効率的かつ体系的に理解を深めることができます。
また、これらの異化経路には酸化的脱炭酸やクライゼン縮合など、生化学上きわめて重要な反応が含まれており、それぞれの反応機構を理解することは、生体内のエネルギー代謝や合成反応などの理解にも役立つことでしょう。特に、メチオニン異化の中間体として現れる SAM(S-アデノシルメチオニン) は、強力なメチル基供与体としてさまざまな代謝反応に関与する点で、生理学的にも重要です。
本記事では、単にアミノ酸の異化経路を追うだけでなく、代謝中間体の意義や各反応のメカニズムにまで踏み込んで詳しく解説しました。アミノ酸代謝の学習において本記事が一助となれば幸いです。ぜひ、繰り返し読み返して理解を深めてください。
参考文献
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.633-662, pp.597-632
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.477-513
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 208-223
- KEGG PATHWAY DATABASE. 2025-03-03. https://www.genome.jp/kegg/pathway.html
- Goodwin, G. W., Rougraff, P. M., Davis, E. J., & Harris, R. A. (1989). Purification and Characterization of Methylmalonate-semialdehyde Dehydrogenase from Rat Liver. Journal of Biological Chemistry, 264(25), 14965–14971. https://doi.org/10.1016/S0021-9258(18)63797-4
- Sokatch, J. R., Sanders, L. E., & Marshall, V. P. (1968). Oxidation of methylmalonate semialdehyde to propionyl coenzyme A in Pseudomonas aeruginosa grown on valine. The Journal of Biological Chemistry, 243(10), 2500–2506. https://doi.org/10.1016/s0021-9258(18)93403-4