ユビキチン化されたタンパク質はプロテアソームによって分解されます。この一見単純な過程は多くの因子がによって達成されます。また、単なる分解にとどまらず多様な生理的意義を持ちます。本記事ではその仕組みのみならず細胞周期の制御、遺伝子転写の制御、免疫系との関連などユビキチン-プロテアソーム系の意義について多角的に解説します。
Contents
ユビキチン化されたタンパク質はプロテアソームにより分解される
寿命を迎えたタンパク質はユビキチン化を受けることで分解される準備が整います(この過程はこちらで紹介していま)。ではユビキチン化標的タンパク質はどのようにして分解されるのでしょうか?
タンパク質の分解を担当するのは 26S プロテアソーム(26S proteasome)というタンパク質複合体が担います。このシステムはユビキチンが目印となり、プロテアソームがタンパク質分解担うことからユビキチン-プロテアソーム系(ubiquitin-proteasome system)と呼ばれます。プロテアソームはポリユビキチン鎖を特異的に見分けて結合し、タンパク質を分解します。この過程でユビキチンは切り離され、再利用されます。一方でタンパク質はより短い断片であるペプチド鎖に分解され、他の細胞内プロテアーゼによってさらに分解され、個々のアミノ酸になります。アミノ酸の一部は他のアミノ酸生合成に再利用されますが、再利用されなかったアミノ酸はアミノ基が外されて炭素骨格が遊離します。アミノ基は尿素回路により尿素に変換されて排泄されます。一方で炭素骨格はさらなる異化経路を経てグルコース・グリコーゲンの合成に利用されたり、TCA 回路や解糖系、脂肪酸合成と合流していきます(図1)。このように、タンパク質が分解されると最終的にグリコーゲンの合成や細胞の呼吸、脂肪酸合成経路と合流することになります。
ところで、プロテアソームはどのようにしてユビキチン化タンパク質のみを見分けているのでしょうか?次にその仕組みを見ていきましょう。
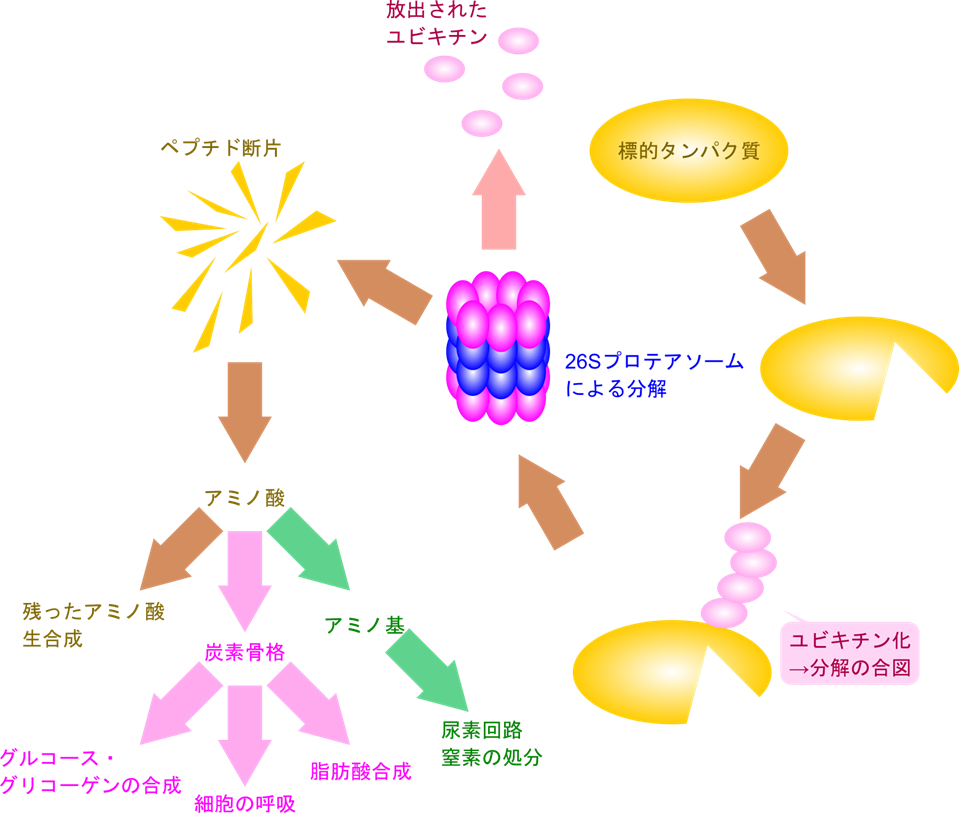
プロテアソームの構造と機能
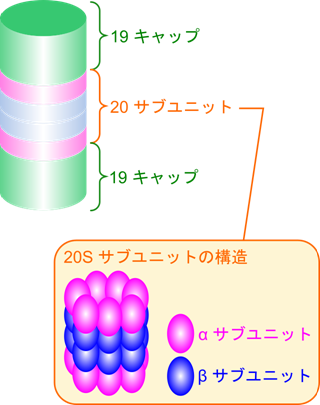
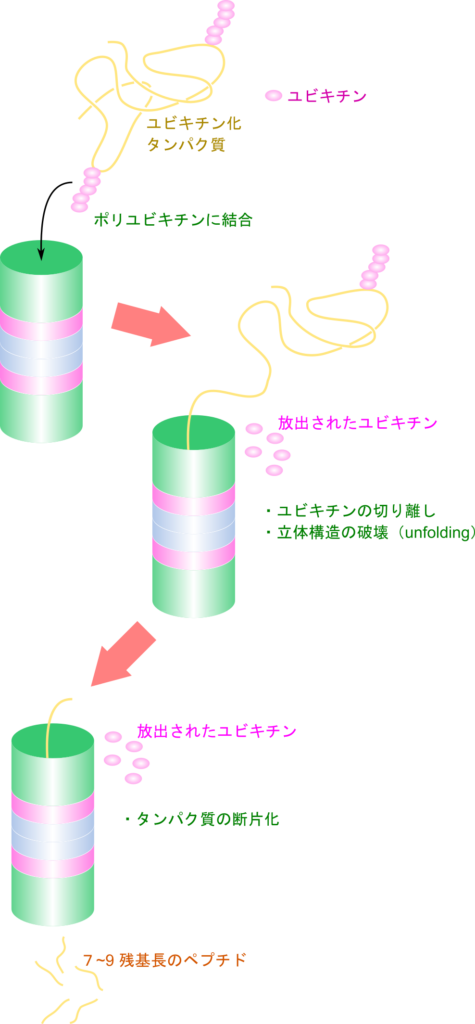
26S プロテアソームは非常に大きなタンパク質複合体で、円筒状の構造をした 20S 触媒ユニットとその両端をキャップするように二つの 19S 調節ユニットが位置しています(図2)。19S 調節ユニットには Rpn10、Rpn13、Rpn1 などのユビキチン受容体(ubiquitin receptor)を内包していてポリユビキチン鎖と特異的に結合できます。この特異的な結合のため、ユビキチン化されたタンパク質のみが選択的に分解対象となります。さらに 19S 調節ユニットは Rpt1–Rpt6 から成る AAA(ATPase associated wih diverse cellular activities;細胞活性と関連する ATP アーゼ)ファミリー*のATP アーゼが含まれており、ATPの加水分解により得られたエネルギーを利用して、標的タンパク質の高次構造を解きほぐします(unfolding)。また、19S 調節ユニットの Rpn11 は脱ユビキチン化酵素(deubiquitinase)として機能し、リシン残基に結合していたユビキチンを標的タンパク質から切り離して放出し、再利用可能な状態に戻します。変性された基質タンパク質は、Rptサブユニットの働きで開いた20Sコア粒子のゲートを通過し、内部に送り込まれます。プロテアソーム内ではこの基質タンパク質がペプチドレベルにまで分解され、7〜9残基程度のペプチド断片になります(図3)。
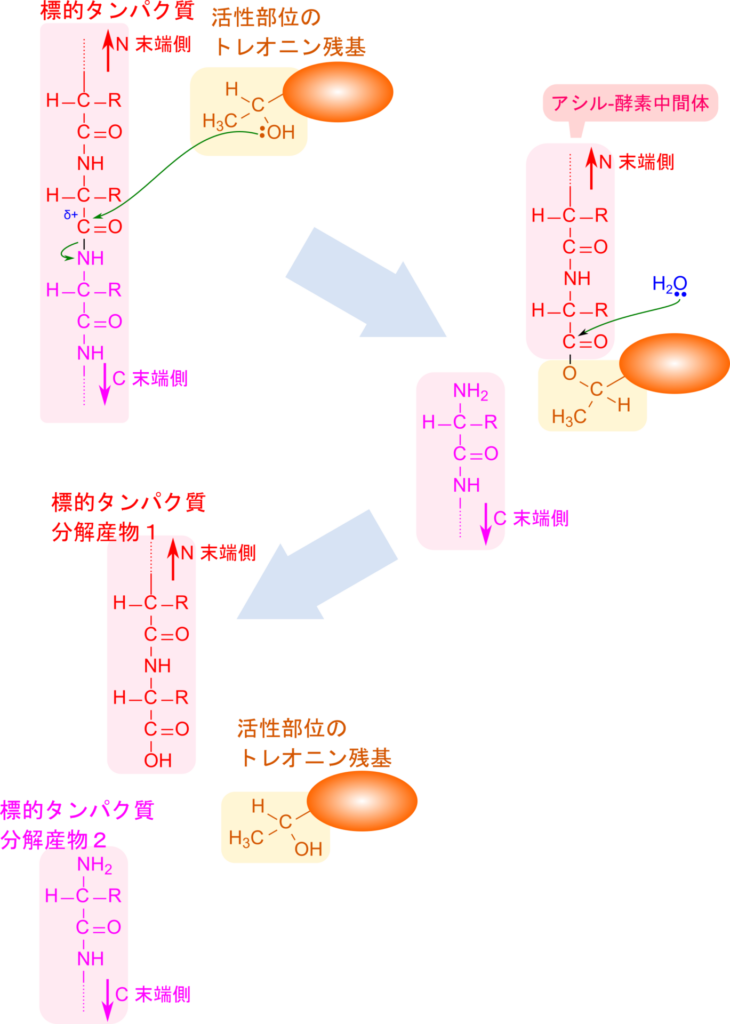
次に、このタンパク質分解メカニズムについてみていきましょう。20S 触媒ユニットの内部にはいくつかの活性部位がありますが、いずれも N 末端にトレオニン残基が含まれています。このトレオニン残基の水酸基(-OH)が求核試薬として機能し、ペプチド結合のカルボニル基を攻撃して標的タンパク質の N末端側の断片と共有結合を形成し、アシル-酵素中間体が形成されます。一方で、C 末端側の断片はアミノ基が脱離基となって遊離します。次に、アシル-酵素中間体が加水分解を受けてエステル結合が切断され、トレオニンともう一方の断片に分かれます。このようにして標的タンパク質は切断されていきます(図4)。
* タンパク質ファミリー:
タンパク質におけるファミリーとは、共通の祖先に由来し、遺伝的に同じグループに分類されるタンパク質群を指します。これらはアミノ酸配列や立体構造に類似性があり、同じファミリーに属するタンパク質同士は、しばしば似た構造や機能を持っています。
ユビキチン-プロテアソーム系によるタンパク質分解の意義
タンパク質の分解とアミノ酸の再利用
ユビキチン-プロテアソーム系により分解されたタンパク質は、その後、細胞内に存在する他のプロテアーゼによってさらに断片化されます。これらのプロテアーゼには、トリペプチジルペプチダーゼII(Tripeptidyl-peptidase II;TPP II)、チメトオリゴペプチダーゼ(Thimet oligopeptidase;THOP1)、ロイシンアミノペプチダーゼ(Leucine aminopeptidase ;LAP)などが知られています。これらのプロテアーゼによりアミノ酸単位まで分解されたのち脱アミノ化を受けます。遊離したアミノ基は尿素回路などを経由して排泄されていきます。一方で、炭素骨格については様々な以下経路を経て、グリコーゲンの合成経路、解糖系・TCA 回路などの呼吸経路あるいは脂肪酸合成経路に合流します。このように、タンパク質は単純に分解されるだけでなく、エネルギー代謝や各種生体分子の生合成に再利用されていきます。
タンパク質分解による生理過程の調整
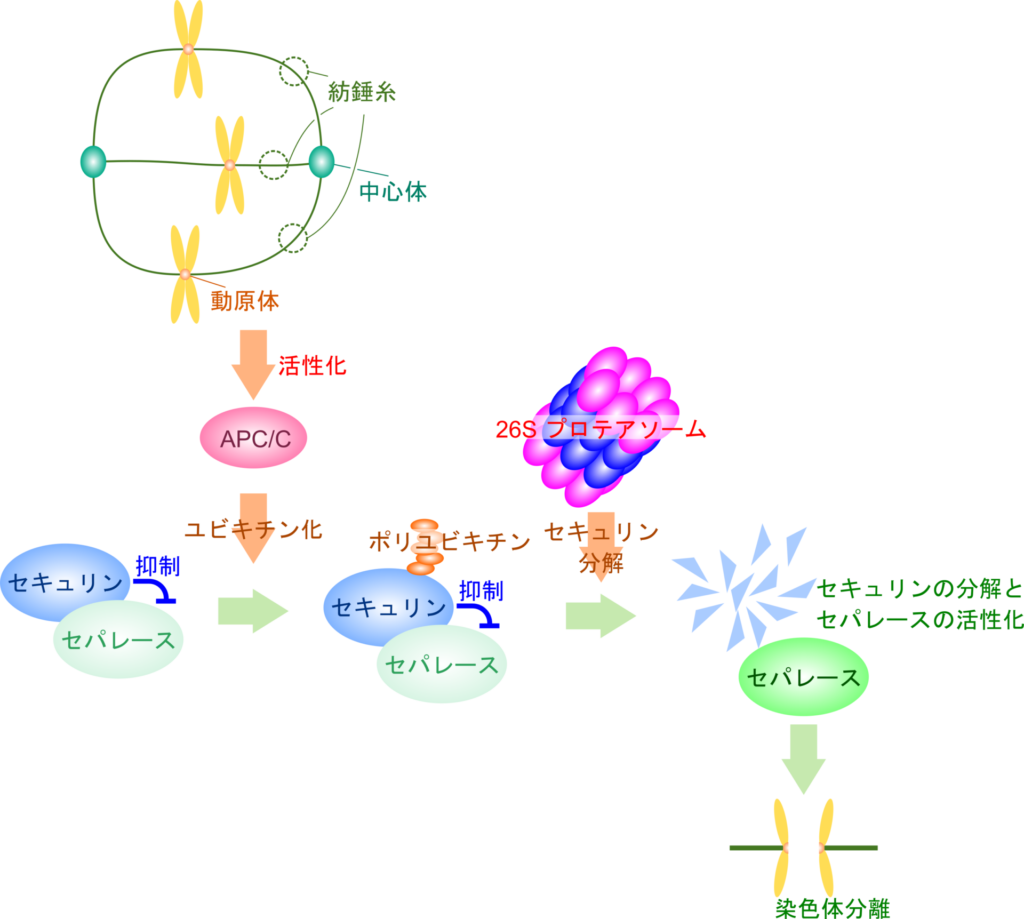
ユビキチン-プロテアソーム系によるタンパク質分解はいくつかの生理活性を調節する役割を担っている場合があります。代表的な例はセキュリンによるセパレース活性の調節です(この例は以前に紹介していますので、詳しくはそちらを参照してください。今回は簡単に概説するにとどめます)。セパレースは染色体分離に関与していますが、紡錘体と動原体が結合するとセキュリンのユビキチン化が誘導され、プロテアソームによる分解が起こります。するとセキュリンによる制御がなくなるため、セパレースが活性化されて染色体分離が誘導されます(図4)。
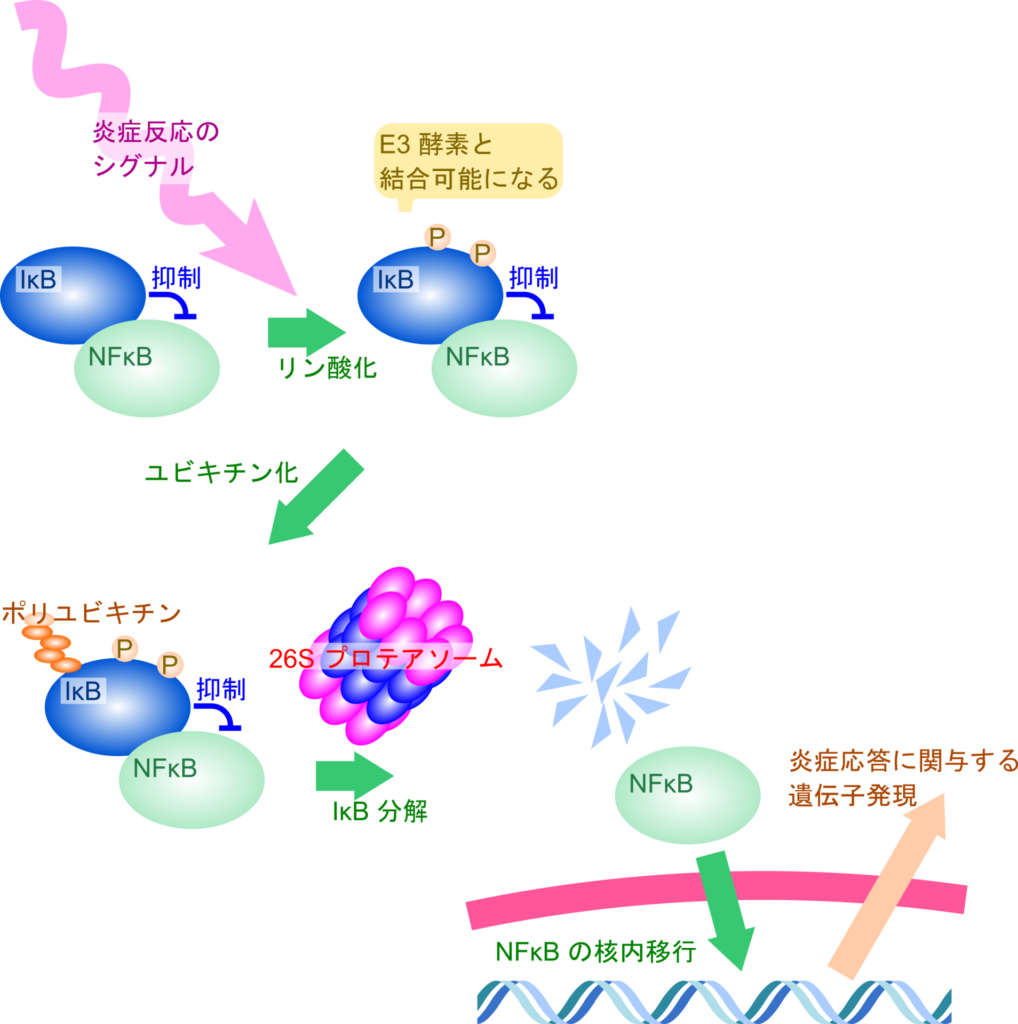
もう一つの例を見ていきましょう。NFκB は炎症性サイトカインや免疫関連因子、細胞接着因子などの炎症応答に関連する因子の発現を誘導する転写因子として知られています。NFκB には IκB が結合しており、NFκB の活性を阻害しています。細胞膜上に発現している様々なレセプターがサイトカインなどの炎症反応を誘導するシグナルを受け取ると、細胞内にシグナルを伝達します(この細胞内のシグナルは、多数の因子が関与する連続的なリン酸化反応として伝達されます。この一連の反応は細胞内シグナル伝達カスケードと呼ばれます)。IκB がこのシグナルを受け取ると IκB の2 か所のセリン残基がリン酸化されることで E3 酵素と結合できるようになり、ユビキチン化が誘導されます。その後、26S プロテアソームによる分解を受けると NFκB の阻害が解かれ、NFκB が核内に移行して種々の遺伝子発現を誘導します。
このような過程はいずれもユビキチン-プロテアソーム系によるタンパク質分解がそれに続く生理過程を調節している例になります。このような過程は様々な場面で散見され、細胞周期の進行、遺伝子の転写だけでなく、器官形成、体内時計、炎症反応、腫瘍の抑制、コレステロール代謝、抗原のプロセッシングでも見られます。
ユビキチン-プロテアソーム系と抗原提示
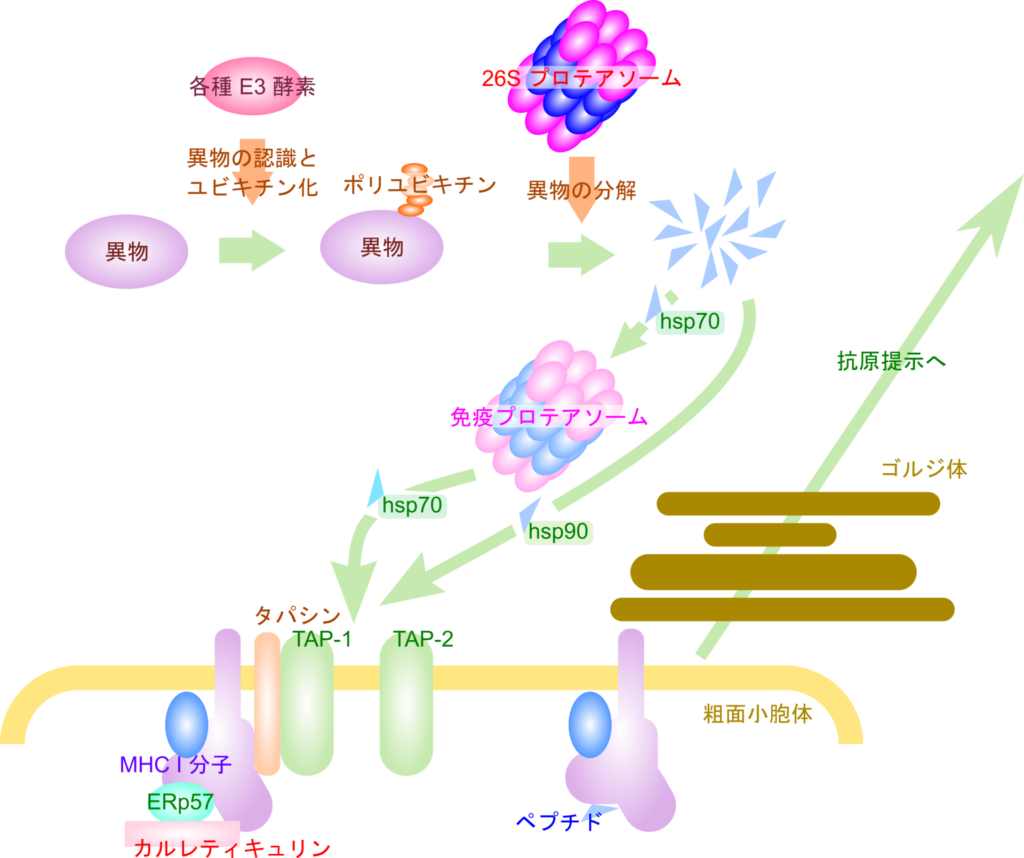
ユビキチン-プロテアソーム系は免疫にも深く関与する仕組みです。細胞内に侵入してきたウイルスに由来する異物や異常タンパク質は各種 E3 酵素により認識されてユビキチン化を受けたのちユビキチン-プロテアソーム系によって分解を受けます。このタンパク質分解には 26S プロテアソームが関与しますが、樹状細胞などの一部の細胞では 26S プロテアソームだけでなく、免疫プロテアソーム(免疫プロテアソームは、26Sプロテアソームと基本構造は共通していますが、20Sコア粒子内の一部のβサブユニットが、免疫誘導型のサブユニットに置き換わっている点で異なります。)も関与します。分解されたタンパク質は hsp70 や hsp90 などの因子の助けやいくつかのプロテアーゼによりトリミングを受けて MHC と結合できるようにされたのち、TAP(transporter associated with antigen processing)複合体を通じて小胞体へ送られ、MHC クラスⅠと結合させられます。こうして形成されたペプチド-MHC 複合体はゴルジ体を経由して細胞表面に運ばれて、T 細胞へ提示されます。この過程は抗原提示と呼ばれ、特に MHC クラスⅠが関与する場合は、細胞性免疫を誘導するステップとして重要です。このように、ユビキチン-プロテアソーム系は免疫の誘導においてもとても重要な役割を担っています(図6)。
練習問題
26S プロテアソームの構造に関する記述で正しいものを選べ。
19S 調節ユニットの機能を一つ選べ。
標的タンパク質の分解の過程を正しく並べ替えろ。
回答欄(上から順に並べてください)
ユビキチン-プロテアソーム系により生成されたペプチドに関する記述で正しいものを選べ。
ユビキチン-プロテアソーム系の機能に関する記述として正しいものを選べ。
今回は、タンパク質の分解について解説しました。生体内には非常に多様なタンパク質が存在し、それらは分解を通じてさらに多様な機能的断片へと変化します。こうしたタンパク質の中から、不要あるいは役目を終えたものを選び出して分解するプロセスは、精緻に制御された仕組みのもとで行われています。
さらに、タンパク質分解は単なる分解にとどまらず、次の生理反応のトリガーになったり、抗原提示に利用されるペプチドを供給するなど、多面的な生理的意義を担っています。
本記事では、タンパク質分解の仕組みに加えて、その持つ多機能性や生体調節における役割にも焦点を当てて解説しました。繰り返し読み返しながら理解を深めていただければ幸いです。
参考文献
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.633-662
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.477-513
- Bard, J. A. M., Goodall, E. A., Greene, E. R., Jonsson, E., Dong, K. C., & Martin, A. (2018). Structure and Function of the 26S Proteasome. Annual Review of Biochemistry, 87(1), 697–724. https://doi.org/10.1146/annurev-biochem-062917-011931
- Saric, T., Graef, C. I., & Goldberg, A. L. (2004). Pathway for Degradation of Peptides Generated by Proteasomes. Journal of Biological Chemistry, 279(45), 46723–46732. https://doi.org/10.1074/jbc.M406537200 (proteasome)
- Ferro, E. S., Gewehr, M. C. F., & Navon, A. (2020). Thimet Oligopeptidase Biochemical and Biological Significances: Past, Present, and Future Directions. Biomolecules, 10(9), 1229. https://doi.org/10.3390/biom10091229
- Tomkinson, B. (2019). Tripeptidyl-peptidase II: Update on an oldie that still counts. Biochimie, 166, 27–37. https://doi.org/10.1016/j.biochi.2019.05.012